La Suavidad de La Carne_ Implicaciones FÃ-sicas y BioquÃ-micas Asociadas Al Manejo y Proceso...
-
Upload
martha-alejandra-jimenez-sanchez -
Category
Documents
-
view
7 -
download
2
description
Transcript of La Suavidad de La Carne_ Implicaciones FÃ-sicas y BioquÃ-micas Asociadas Al Manejo y Proceso...
-
Agronoma MesoamericanaISSN: [email protected] de Costa RicaCosta Rica
Chacn, AlejandroLa suavidad de la carne: implicaciones fsicas y bioqumicas asociadas al manejo y proceso
agroindustrialAgronoma Mesoamericana, vol. 15, nm. 2, 2004, pp. 225-243
Universidad de Costa RicaAlajuela, Costa Rica
Disponible en: http://www.redalyc.org/articulo.oa?id=43715214
Cmo citar el artculo
Nmero completo
Ms informacin del artculo
Pgina de la revista en redalyc.org
Sistema de Informacin CientficaRed de Revistas Cientficas de Amrica Latina, el Caribe, Espaa y Portugal
Proyecto acadmico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto
-
Aspectos generales sobre la carne y su aceptabilidad
La importancia de la carne como fuente de alimen-tacin para el ser humano data de tiempos muy primiti-vos tal y como lo demuestran numerosos documentosde muy diferentes culturas (Belitz et al. 1985). Con eldesarrollo de la ganadera, la carne toma su papel pri-mordial en la dieta humana, no estando exenta sin em-bargo de manifiestos problemas en su calidad que des-de entonces constituye un reto importante para elproductor. Es as como a medida que se fueron desarro-llando las diferentes civilizaciones sobre la faz de la tie-
rra, el hombre fue dando una gran importancia no sloa la fuente de la carne que consume, sino tambin al ma-nejo de la misma una vez obtenida (Libby 1986). Pro-cesos como la salazn, el ahumado y el secado ya erancomunes en los tiempos prehistricos (Prince et al.1976), y constituan fuentes de conservacin bsica pa-ra el ganadero primigenio. Al da de hoy, el estudio dela carne y de su calidad constituye una de las principa-les reas que integran la investigacin en ganadera deengorde y tecnologa de los alimentos (Rodrguez1986). La razn es simple, pues es en el manejo, sacri-ficio y posterior conservacin y preparacin de la carne,
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
LA SUAVIDAD DE LA CARNE: IMPLICACIONES FSICAS YBIOQUMICAS ASOCIADAS AL MANEJO Y PROCESO
AGROINDUSTRIAL1
RESUMEN
La suavidad de la carne: implicaciones fsicas y bio-qumicas asociadas al manejo y proceso agroindustrial.Actualmente, el problema de la suavidad de la carne repre-senta una gran preocupacin entre los productores, dado queesta variable ha demostrado ser el principal criterio con baseal cual los consumidores juzgan la calidad de la carne. Elproblema es especialmente importante si se considera queuna de cada cuatro degustaciones de la carne resultan insatis-factorias para el consumidor. Este trabajo abord los princi-pales aspectos asociados con la suavidad de la carne tales co-mo la estructura y composicin de la carne, el fenmeno dela contraccin muscular, los cambios bioqumicos post mor-tem como el rigor mortis y la maduracin, y el efecto generaldebido a las operaciones del procesamiento industrial comola coccin y el congelamiento. Mtodos generales para elmejoramiento de la suavidad son discutidos, as como la ac-tividad bioqumica e importancia de las enzimas CALPAI-NAS (calcium ion dependent papain like cisteine proteases).
Palabras claves: carne, bioqumica, suavidad, calpaina,enzimas.
1 Recibido para publicacin el 27 de febrero de 2004.2 Estacin Experimental Alfredo Volio Mata. Facultad de Ciencias Agroalimentarias.
ABSTRACT
Meat tenderness: Physical and biochemical factsrelated to agricultural and industrial process. Nowadays,the problem of meat tenderness is of great concern amongproducers because this parameter has become the mostimportant criteria upon which consumers judge meat quality.This problem is especially critical when it is also a provenfact that one of every four sensorial experiences of theconsumer is unsatisfactory when eating meat. This paperoverviews the main aspects determining meat tendernesssuch has structural and chemical composition of meat,muscular contraction, biochemical postmortem changes(rigor mortis and meant aging) and the general effects causedby industrial processing when cooking and freezing. Generalmethods for improving meat tenderness and the biochemicalactivity of the calcium ion dependent papain like cisteineproteases (CALPAIN) are also reviewed.
Key words: meat, biochemistry, tenderness, calpain,enzymes.
Alejandro Chacn1
REVISIN BIBLIOGRFICA
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
es como se define la calidad y la suavidad de la misma,por lo cual una adecuada sincronizacin de estasvariables genera una mejor aceptacin y por ende ma-yores posibilidades para el ganadero y el industrial.
En un sentido estricto y para el lenguaje popular, sedefine como carne a la musculatura esqueltica de losanimales de sangre caliente tales como el ganado ovino,vacuno, porcino o an equino. Desde un punto de vistalegal y ms amplio, el concepto de carne se hace exten-sivo a todas aquellas partes de los animales de sangrecaliente que el hombre utiliza para su alimentacin (Be-litz et al. 1985). Desde esta perspectiva, tambin se in-cluyen entonces las vsceras, la grasa, la sangre y los r-ganos tales como la lengua, el hgado, los riones, lossesos, etc (Potter 1978; Belitz et al. 1985). La carne delas aves y los peces tienden a ser llamadas carnes blan-cas para diferenciarlas de la carne proveniente de anima-les de cuatro patas o carnes rojas (Potter 1978).
Como alimento, la carne es una fuente primaria deprotenas de alta calidad, vitaminas y de minerales co-mo el hierro (Rodrguez 1986). La composicin de lacarne vara segn la especie, la edad y el sexo. Estas di-ferencias no deben ser vistas como curiosidades deriva-das del anlisis, pues en gran parte determinan la acep-tacin y la calidad sensorial final de la carne (Cole et al.1975). La composicin qumica tpica de la carne pro-veniente de los mamferos se detalla en el Cuadro 1.
La jugosidad, el sabor y la suavidad son los principa-les componentes sensoriales asociados con la carne(Epley 1992). Mientras que la jugosidad y el sabor cier-tamente contribuyen con el agrado general, los consumi-dores catalogan a la suavidad como el variable ms im-portante asociado a la aceptacin final de la carne (Smith1997). Lo anterior es de gran importancia, sobretodo sise considera que aunque la jugosidad y el sabor normal-mente no varan significativamente, la dureza puede va-riar considerablemente entre un corte y otro (Epley 1992).
La inconsistencia en la suavidad de la carne es ungran problema que afecta a la industria (Field et al.1997). Muchos consumidores coinciden en que la car-ne es en muchas ocasiones dura, tanto as que una decada cuatro experiencias de consumo resulta insatisfac-toria (Smith 1997). Datos como este hacen que la in-vestigacin de metodologas orientadas a solucionar es-te problema sea de una alta prioridad industrial hoy enda (ABBA 1998).
Factores relacionados con la suavidad de la carne
Muchos son los factores asociados a la dureza queson descritos por la bibliografa. Entre ellos se puedemencionar el tamao del msculo, existiendo mayorsuavidad a menor tamao, la localizacin del msculoen el animal vivo, la funcin fisiolgica del msculo(Bayliss 1995), la edad del animal, la especie (BrithishNutrition Fundation 1988), el sexo, factores genticos(Epley 1992), procesos industriales posteriores a la ma-tanza (Smith 199; Bayliss 1995), y hasta el temperamen-to del animal (Voisinet et al. 1997). Contrariamente a lacreencia popular, el tipo de alimentacin suministrada alanimal no tiene un efecto importante o al menos de rele-vancia prctica en la dureza (Epley 1992; Mills et al.1992; Jeremiah et al. 1998; Sinclair et al. 1998), siendonicamente de inters cuando en la dieta se incluyen ar-bitrariamente antagonistas como el cimaterol y el clen-buterol que pueden favorecer el endurecimiento (Bergeet al. 1993; Speck et al. 1993; Eisemann 1996; Simmonset al. 1997). Estas sustancias constituyen un grupo decompuestos que emulan la accin bioqumica de la adre-nalina y la noradrenalina (Eisemann 1996).
Todos los factores anteriores comparten un funda-mento comn: la composicin de la carne y el compor-tamiento de esta posteriormente al sacrificio. Funda-mentalmente la dureza de la carne se encuentradeterminada por la ultra estructura que conforman losdiferentes componentes de la misma tales como las pro-tenas, la grasa y el tejido conectivo, as como por lacantidad y calidad de estos componentes (Willems et al.1997, Takahashi 1992, Epley 1992, 1998, Texas A&MUniversity 1999, Rodrguez 1986). De este modo lacomposicin y organizacin estructural sumadas a loscambios bioqumicos postmortem son elementos im-portantes al describir el mecanismo que define la textu-ra final de un corte de carne (Ouali 1990).
Componentes estructurales del msculo asociadoscon la textura
La grasa (Nishimura et al. 1999), el tejido conecti-vo (Bruce et al. 1990) y las protenas miofibrilares
226
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
Cuadro 1. Composicin qumica porcentual del msculo es-queltico en los mamferos despus del rigor mortispero antes de los cambios degradativos post mortem.
Componente Porcentaje (%)
Agua 75,0Protena miofibrilar 11,5Protena sarcoplasmtica 5,5Tejido conectivo 2,0Grasa 2,5Carbohidratos 1,2Sustancias miscelneas 2,3
Fuente: Cole & Lawrie, 1975.
-
(Foegeding et al. 1995) han sido descritos como facto-res relacionados con la textura de la carne.
Grasa
Mucha de la grasa presente en el animal vivo eseliminada una vez que el mismo es sacrificado (Swa-tland 1999). La principal relacin atribuida a la grasacon respecto a la suavidad de la carne radica en el he-cho de que esta podra depositarse intramuscularmenteen forma abundante en los animales bien alimentados.Como resultado se produce un debilitamiento del tejidoconectivo intramuscular mejorndose en teora la textu-ra general (Nishimura et al. 1999). No obstante, esteproceso denominado marmoleo marbling (Potter1978), es en teora slo aplicable a ciertos cruces de ga-nado que son capaces de depositar cantidades de grasaintramuscular no menores al 8% (Nishimura et al.1999). Adems la evidencia cientfica a este respectono es muy abundante (Swatland 1999), estando la gra-sa entonces tericamente ms asociada a la jugosidadque a la dureza final.
Tejido conectivo
El tejido conectivo hace una contribucin aprecia-ble a la dureza de la carne (Swatland et al. 1997), msde la que se puede atribuir a la grasa. Se encuentracompuesto de dos fracciones principales: el colgeno yla elastina. La elastina corresponde a la fraccin del te-jido conectivo con propiedades ms elsticas y sueleencontrarse prioritariamente en aquellos msculos quepresentan mucha actividad. Esta resiste condicionesqumicas muy severas como la acidez, la alcalinidad yel calor que usualmente destruyen al colgeno; esto ha-ce afortunado el que no sea muy abundante en general,pues de ser as se tendran cortes muy duros por los cua-les se poda hacer poco en trminos del mejoramientode la suavidad (Swatland 1997).
El colgeno es el principal componente del tejidoconectivo (Zaglul 1983), y puede ser un aspecto rele-vante al analizar la textura. Se encuentra compuestopor fibrillas conformadas por largas molculas de tro-pocolgeno. Estas molculas a su vez estn formadaspor tres cadenas de polipptidos entramados de maneratal que forman una triple hlice, estructura que otorga laestabilidad a la molcula de colgeno (Belitz et al.1985). El contenido, la estabilidad, y el grado de enla-ce de las molculas que conforman el tropocolgenovara con el sexo, la edad y el tipo de msculo (Swa-tland 1997). A medida que los animales maduran, se daun aumento en los enlaces de tipo covalente entre las fi-bras que conforman las molculas de colgeno, y ms
importante an, entre las molculas individuales de co-lgeno. Estos enlaces, denominados puentes cruzados,aumentan la estabilidad y provocan una disminucin dela protelisis hidroltica y de la solubilidad del colge-no, a la vez que hacen que este tejido no reaccione fa-vorablemente al cocinado (Zaglul 1983). Por lo tantopuede afirmarse que el colgeno afecta la textura gra-cias a la estabilidad de los enlaces internos de las mol-culas de tropocolgeno y de las molculas de colgenoindividuales entre s; estabilidad que aumenta con laedad, la actividad, el gnero y la especie del animal(Cole et al. 1975). La proporcin relativa de los puen-tes cruzados intermoleculares que son solubles conaquellos que son ms estables e insolubles, constituyeun factor de mayor peso al evaluar la textura que el con-tenido total de colgeno en s (Zaglul 1983).
Protenas miofibrilares y sarcoplasmticas.
Amplia evidencia experimental otorga un papelpreponderante a las protenas miofibrilares por encimadel colgeno en cuanto a la textura se refiere, no slopor sus caractersticas estructurales sino adems por loscambios bioqumicos postmortem en que estas se veninvolucradas (Ouali 1990; Suzuki et al. 1993; Yama-noue et al. 1994; Geesink et al. 1995; Taylor et al.1998).
Tradicionalmente las protenas del msculo han si-do divididas en dos grupos segn su solubilidad en lasdisoluciones salinas. As las protenas sarcoplasmticasson solubles en soluciones de baja fuerza inica (0,05M) mientras las miofibrilares lo son en las de alta fuer-za inica (0,5 M) (Hultin et al. 1995).
La actina, la miosina, las troponinas y la tropomio-sina son las principales protenas miofibrilares. La ac-tina representa el 25% del peso de las protenas miofi-brilares y suele tener una masa de 43.000 Daaproximadamente (Murray et al. 1990). La forma bsi-ca de la actina es la actina G que es una cadena linealdelgada. Dos cadenas de G actina se polimerizan enuna doble hlice lineal que en conjunto se denomina ac-tina F. La tropomiosina es una molcula fibrosa linealbicatenaria que se adhiere en el surco de la hlice queforman las dos actinas G cuando estas se agrupan paraformar la actina F. A la tropomiosina a la vez se unenlas troponinas que son tres molculas llamadas TnT,TnI y TnC de peso molecular similar y cercano a los17.000 Da. La fraccin TnT une a la troponinas restan-tes con la tropomiosina; la fraccin TnI interacta conla miosina, mientras que la TnC tiene la capacidad deligar Ca2+. Dado su bajo peso molecular, las troponi-nas y la tropomiosina tienen poco efecto en la dureza fi-nal de un corte de carne desde un punto de vista de
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 227
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
resistencia fsica a la mordida (Heinze et al. 1994). Noobstante bioqumicamente son vitales en el proceso decontraccin muscular, por lo cual colaboran indirecta-mente a la textura final, dado que a mayor contraccinmuscular se genera ms dureza en la carne (Murray etal. 1990). La miosina constituye un 55% de la prote-na miofibrilar y es un hexmero lineal asimtrico deunos 46.000 Da. Est constituida por dos filamentosgruesos fibrosos de cabeza globular entrelazados enuna doble hlice. La parte globular de la protena pue-de interactuar con el ATP mientras la parte lineal noglobular se une a la actina F.
En trminos generales, un msculo esqueltico seencuentra conformado por clulas alargadas y estrechasllamadas fibras las cuales se disponen en forma parale-la unas con respecto a las otras. Las fibras se encuen-tran encerradas en una delicada membrana plasmticaintegrada por lipoprotenas, mucopolisacridos y tejidoconectivo denominada sarcolema (Price et al. 1976).Rodeando al sarcolema y separando cada fibra de lasdems, se localiza una fina capa de tejido conectivo de-nominada endomisio. Las fibras integran conjuntos de-nominados haces, los cuales se encuentran a su vez ro-deados por una capa ligeramente ms gruesa de tejidoconectivo denominada perimisio. De manera homlo-ga a las fibras, los haces de fibras musculares se agru-pan para formar el msculo encontrndose rodeadas deuna capa gruesa de tejido conectivo llamada epimisio.
Las fibras musculares constituyen las unidades ce-lulares bsicas del msculo (Swatland 1999). Son c-lulas multinucleadas y extremadamente largas que pue-den llegar a medir varios centmetros. Cada fibra estcompuesta por unidades denominadas miofibrillas, lascuales finalmente se encuentran integradas por un arre-glo de protenas miofibrilares (Cole et al. 1975). Lasmiofibrillas estn incluidas en el citoplasma de cada c-lula muscular, el cual se denomina sarcoplasma (Priceet al. 1976). En el interior de la fibra, las miofibrillasse encuentran envueltas longitudinalmente y cada unapor separado por el retculo sarcoplasmtico, el cual esun complicado sistema de vesculas y tbulos que re-visten por completo a cada miofibrilla (Price et al.1976).
Un arreglo entrecruzado de filamentos gruesos demiosina y delgados de actina conforman las miofibri-llas. Estos arreglos se encuentran agrupados en unida-des bsicas secuenciales denominadas sarcmeros. Lossarcmeros conforman la unidad contrctil bsica delmsculo (Belitz et al. 1985; Swatland 1999), y tiene porello una gran importancia en los procesos que determi-nan la dureza final de la carne (Swatland 1999).
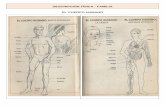
Los sarcmeros se encuentran separados unos deotros por una estructura denominada lnea Z. Adheri-dos perpendicularmente a la lnea Z se encuentran fila-mentos delgados principalmente constituidos por acti-na. Dado que el sarcmero est delimitado por doslneas Z, se tienen dos grupos de filamentos de actina,tambin denominados bandas I, dirigidos desde los ex-tremos hacia el centro del sarcmero. En la parte cen-tral del sarcmero, entre las bandas I opuestas, se ubi-can unos filamentos gruesos formados por miosina queintegran la llamada banda A. Los extremos de estos fi-lamentos gruesos se enlazan a los extremos libres de lasfibras de actina de las bandas I. En la parte central dela banda A existe una regin denominada zona H, lacual corresponde a la parte de la banda A que no est li-gada a las bandas I cuando el sarcmero est relajado.La zona H se encuentra a su vez dividida por una ban-da oscura denominada lnea M, la cual tiene una fun-cin de soporte (Belitz et al. 1985). En la Figura 1 sedetalla la organizacin estructural del msculo y delsarcmero.
Cambios Post-mortem en el procesamiento de lacarne
Rigor mortis
El proceso de contraccin muscular en el msculoviviente es en esencia un acortamiento del sarcmero
228
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
Figura 1. Organizacin ultraestructural del msculo.
-
provocado por el movimiento relativo que se da entrelos filamentos de actina y de miosina (Cole et al. 1975).Como reaccin a un estmulo nervioso, se libera una se-al en forma de acetilcolina que llega a la membranadel sarcmero donde se encuentra el retculo sarcopla-mtico (Murray et al. 1990). El retculo sarcoplasmti-co mantiene grandes cantidades de Ca2+ inmobilizadogracias a una sustancia llamada calsecuestrina (Gordonet al. 2000). A travs de canales transversales el calcioentra y se pone en contacto con los sarcmeros, aumen-tando la concentracin de este in hasta unos 10-5
mol/l. El in se fija a la troponina TnC formndose elcomplejo TnC.4 Ca2+ (Murray et al. 1990). Esta unincambia la conformacin de la tropomiosina adherida alas troponinas, dndose un cambio de forma tal que ha-ce que la tropomiosina se retire y permita a la actina yla miosina ponerse en contacto en el rea de la cabezaglobular de esta ltima. Se forma as una unin estableentre miosina y actina. Esta cabeza globular es capazcomo se dijo de hidrolizar al ATP. Al efectuar esta hi-drlisis parcial del ATP se forma en la cabeza un com-plejo llamado ADP-Pi-Miosina lo cual hace que estacabeza cambie de forma y de posicin (Gordon et al.2000). Como la cabeza est muy unida a la actina, alcambiar de posicin arrastra consigo a la actina (a lacual estaba unida) provocando un desplazamiento.Despus de provocado el desplazamiento, la cabeza demiosina libera el ADP-Pi apenas entra en contacto conun nuevo ATP adoptando la configuracin inicial y rei-niciando el ciclo de modo que se va contrayendo cadavez ms el msculo (Murray et al. 1990; Gordon et al.2000). As mientras la concentracin de Ca2+ sea altay exista ATP disponible el sarcmero continua contra-yndose. Este movimiento provoca en un sarcmeroque los filamentos de actina ubicados en los extremosavancen uno hacia el otro, inclusive hasta el punto detraslaparse (Cole et al. 1975). Los filamentos gruesosse deslizan en medio de los delgados, de manera que labanda A mantiene un tamao constante a medida quelas bandas I se acercan una a la otra (Swatland 1998).Al desaparecer el estmulo el retculo sarcoplasmticoretira el calcio que fue liberado al principio a travs debombas dependientes del calcio hasta que la concentra-cin baja a menos de 10-7 mol/l; as el complejo TnC.4Ca2+ desaparece; la tropomiosina se reacopla; terminala interaccin actina-miosina y el proceso se revierte(Murray et al. 1990). La energa requerida para esteproceso proviene de la hidrlisis del ATP (Belitz et al.1985) y es muy importante notar que tanto para con-traer como para relejar el msculo se requiere de ATP.
La contraccin es muy importante al evaluar la du-reza de la carne, dado que cuando los sarcmeros estncontrados, se presentarn ms protenas aglutinadas alo largo de las fibras musculares (Rodrguez 1986). Asla carne con sarcmeros contrados tiende a ser ms du-
ra a medida que la contraccin es ms acentuada (Swa-tland 1999).
La organizacin estructural del sarcmero y losmecanismos de la contraccin son muy importantes pa-ra entender la textura final, pues estos se intercalan conlos procesos fisicoqumicos, enzimticos y metablicospropios de los cambios postmortem que transforman elmsculo en carne destinada al consumo (Ouali 1992,Bruce et al. 1990, Taylor et al. 1995).
Una vez sacrificado y desangrado un animal finali-za el flujo de oxgeno al msculo, siendo la poca canti-dad remanente en estos tejidos rpidamente consumido(Swatland 1999, Belitz et al. 1985). Bajo estas condi-ciones anaerobias el ciclo de Krebs se encuentra dete-nido. La necesidad de energa lleva a las clulas a con-sumir el ATP existente con rapidez, y a reponer elmismo usando ahora la va glicoltica anaerobia. En es-te proceso por cada molcula de glucosa se generan dosmolculas de ATP y dos molculas de piruvato (Bishopet al. 1999). Posteriormente, la enzima denominadalactato deshidrogenasa cataliza una reaccin que inte-gra un hidrgeno a la molcula de piruvato generandocido lctico (Swatland 1999). La generacin del ATPpor esta va contina hasta el agotamiento del glucge-no. A medida que se alcanza este punto, se va presen-tando un descenso en el pH muscular a consecuencia dela acumulacin de cido lctico, llegndose hasta valo-res aproximados de 6,5 inclusive por debajo de 5,8(Belitz et al. 1985).
La contraccin y relajacin muscular requieren delATP como fuente energtica. Antes de que una mol-cula de miosina pueda liberarse de la actina durante lacontraccin del sarcmero, es requerido el ATP. Alagotarse el ATP, la miosina se mantiene adherida a laactina an si el msculo est tratando de relajarse (Swa-tland 1998). Como consecuencia al agotarse el ATPproducido por la gliclisis anaerobia el msculo se en-durece notablemente, estado que se denomina rigormortis y que se alcanza entre las 10 y 24 horas posterio-res a la muerte (Belitz et al.1985). La cada del pH tie-ne influencia directa en la capacidad de retencin delagua del msculo la cual es menor a bajos pH. Estedescenso tambin altera las interacciones entre las pro-tenas miofibrilares afectando la fragmentacin de lasmismas y por ende la dureza final (Swatland 1999).
En base a lo antes mencionado es importante elcontrol en el manejo del animal antes del sacrificio. Unanimal que sufra de mucho maltrato antes del sacrificioes muy probable que sea presa del estrs e hiperactivi-dad, iniciando como consecuencia la produccin en vi-da de cido lctico que posteriormente afectar la cali-dad de la carne. As mismo si un animal no experimenta
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 229
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
un ayuno total controlado 24 horas antes de la matanza,es muy probable que al ser sacrificado posea muchaenerga en forma de glucgeno en el msculo. Por elloeste animal tendr mucha fuente de glucgeno paratrasformarlo en cido lctico durante el rigor mortis ge-nerando una mayor contraccin y una acidez muy baja(Belitz et al. 1985). Ambos resultados no son deseablesen la carne.
Maduracin
Una vez completado el rigor mortis, se iniciancambios en la carne que tienden a hacer que la mismase vuelva progresivamente ms suave, a la vez que semejora el sabor y el aroma (Jones et al. 1991; Epley1992; Troy 1994; Xiong et al. 1996, Swatland 1999,Parrish 1999). Estos cambios que ocurren naturalmen-te en los tejidos musculares almacenados en refrigera-cin, ya sean empacados al vaco o suspendidos en lacanal, se denominan en conjunto maduracin. La me-jora en la suavidad alcanzada por medio de la madura-cin es generalmente comn a todas las especies de ga-nado (Campo et al. 1999).
El proceso de maduracin es en s complejo, noobstante amplia evidencia experimental establece quelos cambios se deben a la accin de sistemas enzimti-cos endgenos los cuales se encuentran relacionadoscon la ruptura de las protenas miofibrilares claves res-ponsables de la estructura muscular (Buts et al. 1987;Taylor et al. 1995; Ouali 1992; Epley 1992; Troy 1994;Koohmaraie 1994; Parrish 1999; Swatland 1999). A di-ferencia de las protenas miofibrilares, el tejido conec-tivo no es significativamente fragmentado y difcilmen-te cambia durante el perodo de maduracin, por lo cualla mejora en la suavidad no es atribuible a cambios im-portantes en el colgeno o la elastina (Stanton 1989; Ta-kahaski 1992; Nishimura et al. 1998, Parrish 1999).
La entrada en accin de las enzimas proteolticasest relacionada con el pH que se da en el msculo du-rante la formacin del rigor mortis. Debido a esta va-riacin abrupta del pH, se acelera el rompimiento de lamembrana de los lisosomas, la cual es sensible a valo-res de pH extremos, liberndose as las proteasas cau-santes de la actividad autoltica (Rodrguez 1986; Pur-chas et al. 1993; Yu et al. 1986; Troy 1994; Beltrn etal. 1997).
Durante la maduracin, el aumento en la suavidadse da rpidamente durante los primeros 3 7 das, pe-rodo despus del cual esta mejora es relativamente pe-quea. Perodos de maduracin ms prolongados a tem-peratura de refrigeracin pueden favorecer poco a la
suavidad, y ser causantes de sabores indeseables y cre-cimientos microbianos (Epley 1992; Parrish 1999).
El descenso en el pH, el rigor mortis y la madura-cin se encuentran muy estrechamente relacionados,sobretodo si se toma en cuenta que entre mayor sea ladureza que alcanza el msculo durante el rigor, es me-nos lo que la maduracin puede hacer para revertir lamisma (Swatland 1999).
Sistemas enzimticos asociados con la protelisis yla maduracin
Los principales sistemas enzimticos ligados conla degradacin proteoltica del msculo son las colage-nasas, las proteasas alcalinas, y principalmente las pro-teinasas neutras activadas por calcio y las catepsinas(Ashie et al. 1997).
Muchos autores coinciden en otorgar a las protei-nasas neutras activadas por calcio calpanas, un papelcrucial y preponderante en los cambios asociados conla maduracin, an por sobre las catepsinas (Parr et al.1999; Huang et al. 1998; Gil et al. 1998; OHalloran etal. 1997; Simmons 1997; Hortos et al. 1994; Uytterhae-gen et al. 1992; Uytterhaegen et al. 1994; Alarcn et al.1995; Chow 1996; Cridge et al. 1994; Dransfield 1994;Koohmaraie 1994; Dransfield 1993; Wheeler 1998;Taylor et al. 1998; Prigge et al. 1998; Huang et al.1998). Las catepsinas estn ms relacionadas con laprotelisis a temperaturas cercanas a los 20 C, por locual en teora no habrn de ser un factor de peso duran-te la maduracin en refrigeracin.
Las calpanas constituyen una amplia sper familiade proteinasas intracelulares citoslicas dependientesdel Ca2+, cistena especficas y manifiestas en muchasisoformas, las cuales se encuentran ampliamente distri-buidas en todos los tejidos y muestran una actividad re-gulada a valores de pH fisiolgicos (Sorimachi et al.1997; Suzuki et al. 1998; Prigge et al. 1998; Ono et al.1998; Gilchrist 1999). Este sistema enzimtico ha sidoencontrado en todas las clulas de los vertebrados, aun-que no existe evidencia de su presencia en plantas (Goll1997). En los mamferos se encuentran omnipresentesen todos los tejidos siendo sus caractersticas generalesvariables segn la especie y la ubicacin (Kawashimaet al. 1998; Goll et al. 1999).
Identificadas por primera vez en 1964 en el cerebrode ratas, y purificadas finalmente por Ishura en 1978,las calpanas fueron denominadas inicialmente comoCANP por su nombre en ingls Calcium ActivatedNeutral Protease (Sorimachi et al. 1997; CaBP Data
230
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
Library 1999). Finalmente en 1991, siguiendo las reco-mendaciones de la Conferencia Internacional en Cata-bolismo Intracelular de Protenas, se adopta el nombreCalpain el cual corresponde a la simplificacin de Cal-cium Ion Dependent Papain Like Cisteine Protease(Sorimachi et al. 1997). A partir de calpain deriva eltrmino castellano de calpana, el cual es de uso comnactualmente (Knecht 1999, Universidad Autnoma deBarcelona 1999).
En los mamferos el sistema enzimtico de las cal-panas est integrado por tres protenas omnipresentesbien caracterizadas, y por varias formas complementa-rias que son especficas tanto de la especie como de ca-da tejido (Sorimachi et al. 1997; Goll 1999; Suzuki1999; Sorimachi 1999). A pesar de que este sistema deenzimas ha sido bien caracterizado, la relacin existen-te entre su funcin y su estructura, as como su mecanis-mo de regulacin, su estructura tridimensional, y su pa-pel fisiolgico, son aspectos no del todo comprendidoshoy da (Goll et al. 1992; Baki et al. 1997; Goll 1997;Sorimachi et al. 1997; Elce et al. 1997; Ono et al. 1998,Suzuki 1999; Sorimachi 1999). Estas protenas, que seconsideran pertenecientes a un grupo evolutivo diferen-te al de otras proteasas como la papana, las catepsinasy las caspasas (Sorimachi et al. 1997), se vinculan espe-culativamente con funciones biolgicas relacionadascon el Ca2+ tales como la mitosis y la diferenciacin ce-lular, transmisin de seales, regulacin enzimtica yprocesos propios de la membrana plasmtica (Goll et al.1992; Goll 1997; Suzuki et al. 1998). Tambin puedentener un papel en patologas degenerativas tales como lahipertensin, distrofia muscular, artritis reumatoide, ca-taratas y con la enfermedad de Alzheimer (Ono et al.1997; Kinbara et al. 1998; Suzuki et al. 1998).
Las cuatro calpanas omnipresentemente manifies-tas en lo tejidos de los vertebrados se conocen con nom-bres derivados a partir de sus requerimientos de calcio:calpana, /m-calpana, m-calpana y la calpastatina.La /m-calpana ha sido encontrada hasta el da de hoyslo en aves (Sorimachi et al. 1997).
La -calpana requiere de concentraciones micro-molares de Ca2+ (3-50 M) para alcanzar la mitad de suactividad mxima mientras que la m-calpana necesitade concentraciones milimolares (200-1000 M). La/m-calpana es activa en el rango de 3-1000 M y lacalpastatina acta como regulador o inhibidor de lastres formas antes mencionadas para todas las concen-traciones de Ca2+ (Goll et al. 1992; Baki et al. 1996;Goll 1997; Ono et al. 1998; Suzuki et al. 1998; Kinba-ra et al. 1998; Sorimachi et al. 1997; Goll et al. 1999).El pH ptimo in vivo de estas enzimas se estima entre7,2 Y 8,2 (Goll et al. 1992). No obstante, an a valoresde pH menores al ptimo se registra una actividad de
las calpanas que es suficiente para producir un mejora-miento apreciable en la suavidad de la carne, especial-mente si se permite un perodo de maduracin apropia-do (Wheeler 2000).
En el msculo esqueltico, la -calpana, la /m-calpana y la m-calpana se encuentran generalmente encantidades muy similares, existiendo suficiente calpas-tatina como para inhibir a todas ellas (Goll et al. 1992;Goll et al. 1999). La calpastatina tiene igual capacidadinhibitoria sobre las tres calpanas (Sorimachi 1999;Suzuki 1999), accin que slo puede efectuar en pre-sencia de calcio (Kinbara et al. 1998).
Las calpanas , /m y m estn constituidas sin ex-cepcin por dos subunidades diferentes asociadas entres, de manera tal que cada calpana es en realidad un he-terodmero. As cada calpana est conformada por unasubunidad larga de aproximadamente 80 kDa llamadaCL, /mCL mCL segn el tipo de calpana, y poruna subunidad pequea de aproximadamente 30kDaque es idntica en los tres tipos de proteasa y que es de-nominada 30K (Sorimachi et al. 1997; Ono et al. 1998;Kinbara et al. 1998; Sorimachi 1999; Suzuki 1999).
Tal y como se puede apreciar en la Figura 2, tanto launidad larga como la corta pueden dividirse en seccionesdenominadas dominios, los cuales presentan diferentescaractersticas funcionales. La unidad larga est confor-mada por cuatro dominios. La funcin de los dominiosI y III de la subunidad larga an no ha sido esclarecida
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 231
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
Figura 2. Estructura esquemtica de las subunidades larga ycorta que conforman el heterodmero en las calpanas.
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
(Sorimachi et al. 1997; Ono et al. 1998), aunque se es-pecula que el dominio I puede estar relacionado con laregulacin de la activacin de la enzima y el dominio IIIpuede tener un papel en la identificacin de los substra-tos (Sorimachi 1999; Suzuki 1999). El dominio II co-rresponde a la seccin proteoltica que contiene residuoscatalticos de cistena, aspargina e histidina. Este domi-nio posee una secuencia de aminocidos muy similar alde otras proteasas de cistena como las catepsinas y lapapana, lo cual explica el origen del trmino calpain(Ono et al. 1998). Dado que el dominio II es propio delas subunidades largas, la actividad proteoltica de lascalpanas es ejecutada exclusivamente por estas subuni-dades (Sorimachi et al. 1997; Ono et al. 1998; Kinbaraet al. 1998). El dominio IV corresponde a una seccinprotica muy similar a la calmodulina, y tiene la funcinde ligar el Ca2+ utilizando para tal efecto cinco estructu-ras denominadas EF. Una sexta estructura EF indepen-diente del dominio IV se ubica entre el II y III dominio(Ono et al. 1998).
La subunidad corta 30K est integrada por dos do-minios. El dominio V corresponde a una regin N-ter-minal integrada principalmente por residuos de glicinay poseedora de una naturaleza hidrofbica que se pre-sume permite interacciones con las membranas celula-res. Finalmente est el dominio IV el cual es de natu-raleza muy similar al dominio IV de la subunidad larga.El dominio IV tambin liga Ca2+ y posee igualmentecinco estructuras EF (Sorimachi et al. 1997, Ono et al.1998, Kinbara et al. 1998, Sorimachi 1999, Suzuki1999). No obstante, la estructura EF terminal no ligaCa2+, sino que est ms relacionada con la formacindel heterodmero.
Ha sido sugerido que las unidades largas y cortaspueden asociarse, en ausencia de Ca2+, para dar origena la estructura de heterodmero gracias la interaccin nopolar recproca de la quinta estructura C-terminal EF delos dominios IV y IV respectivamente (Sorimachi et al.1997, Suzuki et al. 1998, Sou et al. 1999). Por mediode la formacin del heterodmero, tanto la fraccin lar-ga como la corta adquieren una mayor estabilidad (So-rimachi et al. 1997, Suzuki et al. 1998).
El papel de la 30K no es del todo comprendido aun-que se sabe que su presencia es necesaria para que se re-gistre la actividad proteoltica. Se especula que esta su-bunidad acta como chaperona de la subunidad largaregulando la sensibilidad de esta por el calcio. Dadoque la 30K es comn a todos los tipos de calpana, lasdiferencias presentes en cuanto a los requerimientos decalcio dependen de la fraccin larga que es la que vara,ejerciendo la 30K su actividad reguladora segn las ca-ractersticas de cada fraccin larga (Sorimachi 1999; Su-zuki 1999). As es definitiva, cada calpana est consti-
tuida por dos unidades asociadas en una estructura deheterodmero: Una fraccin larga sobre la que recae laactividad proteoltica y una fraccin corta reguladoracomn a todas las calpanas (Sorimachi et al. 1997; Onoet al. 1997; Hahn-Jun et al. 1998; Kinbara et al. 1998;Ono et al. 1998; Sou et al. 1999; Sorimachi 1999; Suzu-ki 1999).
En cuanto a la conformacin de la calpastatina, espoco lo que se conoce, pues an no se ha esclarecidodel todo su estructura secundaria exacta (Sorimachi etal. 1998). En rasgos generales, se considera que es unpolipptido integrado por cuatro secciones dominiosinhibidores muy similares de aproximadamente 140aminocidos cada uno, y de una seccin N-terminal de-nominada dominio L de tamao muy variable y hastainexistente segn la especie animal (Goll et al. 1999).Cada una de las cuatro secciones homlogas tiene acti-vidad inhibitoria sobre las calpanas. Se estima que lacalpastatina que se encuentra en el msculo de los bo-vinos es una unidad de 125 kDa (Shannon et al. 1985,Goll et al. 1999).
Los mecanismos de activacin y de accin de lascalpanas son en el presente del todo hipotticos, y porlo tanto no definitivos (Goll et al. 1992; Elce et al.1997; Suzuki et al. 1998; Suzuki 1999; Sorimachi1999). Uno de los aspectos polmicos hasta la fecha esel cmo las calpanas pueden ser activas in vivo, si lasconcentraciones de Ca2+ que las mismas requieren invitro son mucho ms elevadas que aquellas que se pue-de esperar se presenten en una clula (Goll et al. 1992;Goll 1997; Suzuki et al. 1998; Sorimachi et al. 1997).En pocas recientes se ha propuesto un modelo de cas-cada, en el cual la -calpana, al requerir bajas concen-traciones de Ca2+ se activa primero y baja la necesidadCa2+ de la m-calpana, permitiendo la activacin de es-ta ltima en el mbito celular (Tompa et al. 1996, Sori-machi et al. 1997). Bajo este modelo, las calpanas seconsideraban ms bien como proenzimas inactivas has-ta el momento en que el Ca2+ se ligaba a los dominiosIV y IV, provocado as cambios conformacionales queconducan a la autlisis de las subunidades largas y cor-tas; la unidad larga as liberada estaba lista entonces pa-ra ejercer su accin proteoltica (Goll et al. 1992; Kin-bara et al. 1998).
Actualmente es ms aceptado el as llamado meca-nismo de disociacin-autlisis, el cual enriquece el me-canismo de cascada con nuevos elementos generadospor la evidencia experimental. En teora, al ligarse elCa2+ a los dominios IV y IV, se provoca dentro de lacalpana un cambio conformacional conocido comotranslocacin, el cual hace que las regiones no polaresrelacionadas con dichos dominios queden expuestas enla superficie de la molcula (Goll et al. 1992; Elce et al.
232
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
1997, Suzuki et al. 1998). Se estima que las subunida-des largas ligan entre una y dos molculas de Ca2+
mientras que las 30K ligan 4 molculas (Goll et al.1992; Sorimachi et al. 1997).
La cantidad de Ca2+ necesaria para la translocacines mucho ms baja que la observada para la separacincompleta de las subunidades in vitro. A diferencia delas condiciones in vitro, en la clula viva existen fosfo-lpidos y otros activadores que pueden interactuar conla forma translocada de la calpana y hacer que esta sedisocie en las subunidades larga de 80 kDa y corta de30kDa a concentracin de Ca2+ significativamente ba-jas (Suzuki et al. 1998). Por otro lado, si existe sufi-ciente calcio, los fosfolpidos de la membrana puedencatalizar tambin una reaccin de autlisis entre lassubunidades corta y larga, al bajar el requerimiento decalcio para esta reaccin que as puede ocurrir en el m-bito fisiolgico (Suzuki et al. 1998). Se da as una vaalternativa que puede coexistir con la simple disocia-cin. Durante la autlisis, la masa de la subunidad lar-ga queda reducida a 76 kDa y la de la subunidad cortaa 18 kDa, lo anterior debido a la prdida de 91 amino-cidos de la regin N terminal rica en glicina de lasubunidad corta y de 19 27 aminocidos de la reginN terminal de la subunidad larga (Goll et al. 1992, Su-
zuki et al. 1998). Es de esperar que la -calpana se ac-tive directamente por medio de la va de disociacin-autlisis, y que sta una vez activa contribuya a activarla m-calpana, aunque se supone que el mecanismo glo-bal para la activacin de la m-calpana puede ser mscomplejo an (Suzuki et al. 1998).
As tanto por disociacin, como por autlisis (Elceet al. 1997), se pueden lograr formas activas de las cal-panas para bajos requerimientos de Ca+2 por interac-cin de la forma translocada con los fosfolpidos. Elesquema del mecanismo de activacin de una calpanase detalla en la Figura 3.
La calpastatina por su parte acta como inhibidoraltamente especfico de las calpanas (Hang-Jun et al.1998). Esta se liga a los dominios IV y IV de las su-bunidades cortas y largas evitando as la posibilidad deque el Ca2+ pueda interactuar con estas regiones (Sori-machi et al. 1998). El efecto inhibitorio reduce tanto lavelocidad como la magnitud del efecto proteoltico delas calpanas (Geesink et al. 1999). El mismo puede serparcial an en presencia de un exceso de calpastatina(Geesink et al. 1998). Dado que tanto en el heterod-mero como en las formas disociadas y autolizadas, losdominios IV y IV son completamente funcionales, la
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 233
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
Figura 3. Diagrama del mecanismo de disociacin-autlisis de las calpanas.
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
calpastatina puede inhibir a cualquiera de estas formas(Goll et al. 1992).
La calpastatina vara en tamao y cantidad segn laespecie animal, por ello la cantidad de calpanas inhibi-das por cada molcula de calpastatina es variable y ge-neralmente flucta entre tres y cuatro molculas de cal-pana por cada molcula de calpastatina (Goll et al.1992). En el ganado bovino, la raza cebuina se carac-teriza por tener gran cantidad de calpastatina (Pringle etal. 1996). Para que el efecto inhibitorio pueda darse esnecesaria la presencia de calcio, pero en cantidades mu-cho menores a las requeridas para iniciar la activacinde las calpanas (Goll et al. 1992, Yang et al. 1994, Kin-bara et al. 1998). La presencia de -antagonistas se su-pone incrementa significativamente la actividad de lacalpastatina (Goll et al. 1999).
Tanto las calpanas como la calpastatina, que se lo-calizan intracelularmente en forma exclusiva, no se en-cuentran libres en el citoplasma de las clulas muscula-res (Goll et al. 1999). Estas enzimas se encuentranlocalizadas mayoritariamente en la lnea Z de los sarc-meros, y en menor cantidad se encuentran presentes enla banda I (Dayton et al. 1981, Kumamoto et al. 1992;Spencer et al. 1992, Goll et al. 1999). Muchos estudioshan evidenciado el papel de las calpanas en la degrada-cin de la banda Z, rica en titina y nebulina, y de otrasprotenas que sirven de unin entre las miofibrillas y lamembrana plasmtica, aspectos que estn directamenterelacionados con el mejoramiento post-mortem de lasuavidad (Goll et al. 1992, Taylor et al. 1995, Savell1998, Goll et al. 1999). Las calpanas degradan a latropomiosina y a las troponinas T I. Estos sustratoscontribuyen con la estabilidad de los filamentos grue-sos y en el mantenimiento de los monmeros de actinaen la forma filamentosa. Adems degradan la nebulina,la desmina y la titina, las cuales mantienen la estabili-dad del enrejado que forman los filamentos gruesos ydelgados; eliminan varias protenas conocidas como Cy M que mantienen las molculas de miosina ensambla-das en los filamentos gruesos; y no degradan la actina yla miosina (Goll et al. 1991, Goll et al. 1999). As, lostres tipos de calpanas descritos degradan estructural-mente el sarcmero por igual, pero no degradan signi-ficativamente a la actina y a la miosina en aminocidos(Goll et al. 1999). La habilidad para degradar las pro-tenas responsables del mantenimiento de la estructuramiofibrilar; la localizacin en el citoplasma de las clu-las esquelticas; el contacto directo con los substratos;y el presentar actividad a valores de pH y de fuerza i-nica propios del citoplasma; son caractersticas nicas yslo presentes en las calpanas que hacen de estas elprincipal sistema proteoltico responsable de la prote-lisis post-mortem (Koohmaraie 1992, Goll et al. 1999).
En los ltimos aos un nuevo miembro de la fami-lia de las calpanas que es predominante en el msculofue identificado y denominado p94. Dicha proteasa po-see una estructura muy similar a las calpanas anterior-mente conocidas y tiene la particularidad de presentaruna muy rpida autlisis y de no ser inhibida por la cal-pastatina (Kinbara et al. 1998, Sorimachi et al. 1997,Sorimachi 1999, Suzuki 1999). La misma se asocia conla titina y la conectina en el msculo esqueltico (Suzu-ki 1999). Sin embargo, no est claro si esta nueva cal-pana posee efectos similares sobre las miofibrillas alos que poseen las otras calpanas, aunque se suponeque este efecto es muy diferente y no contribuye signi-ficativamente al mejoramiento de la suavidad de la car-ne (Sorimachi 1999, Suzuki 1999). Mucho de lo con-cerniente a esta novel calpana es del todo hipottico(Suzuki 1999).
Mtodos para el mejoramiento de la suavidad de lacarne
Inyeccin con cloruro de calcio
Basndose en el potencial de las calpanas comoentes proteolticos que mellan estructuralmente a lossarcmeros, y habindose establecido que el grado decontraccin y la integridad de los mismos es el factordeterminante en la dureza final de la carne; muchas hansido las pruebas que hasta el da de hoy han demostra-do exitosamente un incremento apreciable en la activi-dad de las calpanas cuando estas se exponen al efectode CaCl2 agregado intencionalmente a la carne (Kooh-maraie 1992, Wheeler 1998). De las diferentes formasde aplicacin, entre ellas la marinacin, es la inyeccinmecnica la que ofrece los mejores resultados gracias ala distribucin ms uniforme de la disolucin salina enla pieza (Wheeler 1998). El cloruro de calcio no puedeser suministrado directamente en la dieta del ganado,pues causara desrdenes graves que generalmente tie-nen como consecuencia la muerte del animal (Wheeler1998).
La inyeccin mecnica de cloruro de calcio en pie-zas de carne, puede ser empleada como un mtodo pa-ra estimular la accin de las calpanas y obtener as unamayor suavidad gracias a la accin proteoltica de di-chas enzimas sobre las lneas Z de los sarcmeros (Cla-re et al. 1997, Wheeler 1998).
Los diferentes estudios hasta la fecha realizadossobre esta metodologa, sugieren que la misma es teri-camente aplicable a todos los cortes indiferentementede la especie, edad, raza y sexo del animal (Wheeler1998, Lourdes et al. 1998). Lo anterior se justifica en
234
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
el hecho antes expuesto de la omnipresencia de las cal-panas en el mbito muscular (Sorimachi et al. 1997;Goll 1999; Suzuki 1999; Sorimachi 1999). Adems,otras ventajas del mtodo han sido comprobadas aescala experimental. En primer lugar, slo los cortesduros reciben el mayor efecto del tratamiento, perma-neciendo los cortes suaves sin ser afectados: no se daas un suavizamiento excesivo en ningn caso (Whee-ler et al. 1992; Wheeler et al. 1993; Wheeler 1998). Asmismo, el costo del CaCl2 apto para el uso en alimen-tos es muy bajo (Wheeler 1998, Sols 1999). Finalmen-te el porcentaje de inyeccin es lo suficientemente re-ducido para que no se registren sabores y oloresindeseables en el producto (Wheeler et al. 1993; Lour-des et al. 1998). No obstante, si se inyecta por encimadel 5% (m/m) de inyeccin de una disolucin al 3%(m/v) en CaCl2 recomendado (Wheeler et al. 1993;Clare et al. 1997; Wheeler 1998), es posible que se de-sarrollen sabores amargos derivados del exceso de incloruro (Got 1996; Lourdes et al. 1998).
La carne puede ser tericamente inyectada en cual-quier momento antes de los primeros 14 das, aunque serecomienda hacerlo a las 24 horas postmortem una vezdada la resolucin del rigor para mejores resultados(Wheeler et al. 1993; Wheeler 1998). La inyeccin an-terior a la resolucin del rigor no est recomendada,pues el calcio contribuira a dar una mayor contraccinde la carne aumentando as la dureza final (Thomson etal. 1997). Es importante que la carne no se someta alproceso de inyeccin si la misma ha sido curada, pueslos fosfatos en las sales de cura podran provocar el en-lace de los iones de calcio obstaculizndose as el pro-ceso (Wheeler 1998).
Segn las recomendaciones de Wheeler (1998), lacarne una vez inyectada se empaca al vaco y se madu-ra durante un perodo de siete das en refrigeracin a 7C. Este perodo es el recomendado para la accin efec-tiva de las enzimas, aunque el mismo puede ser inclusomayor; no es aconsejable sin embargo superar los 35das de maduracin (Wichlacz et al. 1995, Clare et al.1997, Wheeler 1998).
Durante la maduracin en refrigeracin, la activi-dad de la calpanas y de la calpastatina decrece gradual-mente (Kim et al. 1997). En carne bovina, la actividadde la m-calpana cambia lentamente en los primerossiete das de maduracin llegando en este perodo a un60 % de su actividad inicial; por otro lado, la actividadde ?-calpana y de la calpastatina decrece rpidamentellegando hasta un 4% y un 20% respectivamente de suactividad inicial (Boehm et al. 1998). La -calpanapresenta as un descenso dramtico durante el almace-namiento (Dransfiel et al. 1992; Thomson et al. 1996).
An almacenado en congelacin la prdida es muy sen-sible, siendo hasta del 70% de la actividad en un soloda (Dransfield 1996). Se especula que la prdida deactividad moderada de la m-calpana se debe a que lamisma se va ligando a la fraccin miofibrilar quedandogradualmente inactiva (Boehm et al. 1998). Por su par-te la calpastatina y la -calpana sufren una rpida de-gradacin con el tiempo, la cual inclusive puede sercausada por las mismas calpanas (Doumit et al. 1999).
El empaque al vaco no slo es una condicin ne-cesaria del mtodo, si no que adems ha demostrado fa-vorecer ampliamente el mejoramiento de la suavidad dela carne (Golovkin et al. 1984). Adems, protege la su-perficie del alimento contra la contaminacin y la dese-cacin (Muller 1990; Sparakowski 1991); reduce laoxidacin (Barbut et al. 1990, Sparakowski 1991); au-menta la vida til facilitando a la vez el almacenamien-to (Chomon 1987; Boers 1988; Muller 1990; Becherel1991); y estabiliza el color en carnes congeladas (Shayet al. 1987; Farouk et al. 1998). A todo lo anterior sedebe sumar la mayor aceptabilidad del producto final sieste se encuentra empacado (Costell 1992).
Una vez completado el perodo de siete das en ma-duracin el tratamiento est terminado y la carne se en-cuentra lista para su consumo, o bien para ser sometidaotros tratamientos como la coccin o la congelacin(Wheeler 1998).
Coccin
El origen de la coccin de la carne es tan antiguocomo la civilizacin misma, y muy probablemente ocu-rri en un principio al ser esta expuesta en forma acci-dental al fuego o al calor (Kramlich et al. 1984).
Muchos son los cambios que experimenta la carnecomo consecuencia de la coccin: se da la coagulacinde las protenas alterndose su solubilidad y el color dela pieza (Kramlich et al. 1984; Belitz et al. 1985); el con-tenido de agua decrece como consecuencia de la dismi-nucin de la capacidad de retencin de agua de las pro-tenas (Cole et al. 1975; Price et al. 1976; Kramlich et al.1984; Belitz et al. 1985); la grasa se lica mejorando latextura (Potter 1978); muchas enzimas son inactivadasevitndose el desarrollo de sabores indeseables (Kram-lich et al. 1984); la destruccin de una parte importantede la carga microbiana mejora la vida til (Levie 1974;Kramlich et al. 1984); la aceptabilidad general se mejo-ra al intensificarse el sabor, desarrollarse el aroma y alalterarse la textura (Levie 1974; Cole et al. 1975; Kram-lich et al. 1984; Belitz et al. 1985); y la digestibilidad dela carne aumenta (Levie 1974; Cole et al. 1975).
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 235
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
En trminos de la suavidad, dependiendo de las ca-ractersticas de la carne y del tipo de tratamiento, lacoccin puede disminuir o aumentar la dureza (Potter,1978). Durante un proceso de coccin adecuado, lasuavidad se mejora al transformarse el colgeno de suforma viscosa original en gelatina mucho ms suave, yadems, se produce una separacin de las fibras muscu-lares que tambin contribuye a disminuir la dureza (Le-vie 1974, Cole et al. 1975, Potter 1978, Kramlich et al.1984, Belitz et al. 1985). Si el proceso no es el indica-do, se puede provocar una contraccin de las fibrasmusculares y una prdida de humedad excesiva queprovocaran un producto de mayor dureza que la carnecruda original (Price et al. 1976, Potter 1978). Existeevidencia experimental que registra una reduccin en elefecto de endurecimiento provocado por la coccincuando piezas de carne han sido inyectadas previamen-te con cloruro de calcio (Wulf et al. 1996, Milligan etal. 1997).
En trminos generales, los mtodos de coccin dela carne pueden ser clasificados en dos categoras: coc-cin por calor seco y coccin por calor hmedo (Levie1974, Kramlich et al. 1984). La coccin por calor secoenvuelve a los mtodos donde la carne se cocina rodea-da de aire caliente como en los hornos, o bien donde es-ta se fre en grasa; por otro lado, los mtodos de coc-cin hmeda comprenden aquellos donde la carne secocina por medio de vapores lquidos calientes en loscuales se sumerge la pieza (Kramlich et al. 1984).
La coccin por medio del calor seco es nicamen-te recomendable para aquellos cortes relativamentesuaves de carne (Kramlich et al. 1984). A pesar de queeste mtodo produce un mximo sabor, no suele mejo-rar la suavidad al provocar una solidificacin de lasprotenas que generan una textura de mayor dureza (Le-vie 1974).
El calor hmedo contribuye sustancialmente al me-joramiento de la suavidad gracias a su efecto sobre elcolgeno, por lo cual es el mtodo ms indicado paracocinar piezas de carne de alta dureza (Levie 1974,Kramlich et al. 1984). Al cocinar con calor hmedo, esaconsejable el uso de empaques para las piezas los cua-les contribuyan a disminuir la prdida de jugos durantela coccin (Kramlich et al. 1984). Son estas prdidasde jugos las que hacen ms recomendable la coccincon calor seco en aquellos cortes muy suaves que no re-quieran mejoramiento adicional de la textura (Levie1974). Al cocinar con calor hmedo, los mejores resul-tados se obtienen empleando una combinacin de tem-peraturas inferiores a 80 C y largos tiempos (Potter1978, Honikel et al. 1988, Wheeler 1998, Sols 1999).
Las calpanas son sensibles al calor y generalmen-te se degradan durante la coccin (Duckett 1999). Lacalpastatina por su parte es termorresistente y no es des-truida, pudiendo incluso incrementarse su actividaddespus de un tratamiento trmico (Kim et al. 1997,Duckett 1999). Basndose en lo anterior, es muy pro-bable que no exista un incremento en la suavidad des-pus de la coccin que pueda relacionarse con la activi-dad de las calpanas (Duckett 1999).
Congelacin
Tradicionalmente se define a la congelacin comola conservacin de alimentos a una temperatura dadadentro de un intervalo de 10 C a 30 C, en un estadotal que la mayor parte del agua contenida en ellos se en-cuentra presente en forma de hielo (Jamieson et al.1974).
Los primeros procedimientos de congelacin pues-tos en prctica en los albores de la produccin industrialdel fro consistan nicamente en depositar la carne encmaras a 10 C y sin movimiento de aire; el procesode congelacin demoraba entonces hasta una semana yacarreaba serios problemas de calidad y seguridad. Es-tos problemas se solucionan entre 1916 y 1925 al sen-tar Planck las bases tecnolgicas de la congelacin mo-derna (Jasper et al. 1978). En la actualidad, las tcnicasmodernas de congelacin entre los 18 C y 30 C per-miten mantener la carne de res almacenada hasta porplazos de dos o tres aos (Jasper et al. 1978, Potter1978, Belitz et al. 1985).
Generalmente es aceptado el hecho de que cuandoel proceso de congelacin es efectuado de manera ade-cuada, los cambios adversos en la calidad no son demucha importancia (American Meat Institute Founda-tion 1960, Kramlich et al. 1984).
Como primer aspecto importante al congelar lacarne, es necesario constatar que la misma complete to-talmente la resolucin del rigor mortis antes de iniciarel proceso. Se recomienda no congelar antes de trans-curridas 48 horas despus de la muerte (Kramlich et al.1984). De no ser as, se produce el fenmeno denomi-nado rigor de congelacin cold shortening queafecta la dureza y la calidad final de la carne (Price etal. 1976, Potter 1978, Kramlich et al. 1984, Belitz et al.1985, Rodrguez 1986). En este fenmeno se produceuna degradacin extremadamente rpida del ATP aldescongelar debido a la accin de la miosin-ATPasafuertemente activada por el calcio, con la consiguientedisminucin de la capacidad de retencin de agua y
236
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
contraccin muscular (Belitz et al. 1985). El productofinal pierde entonces muchos fluidos y es duro a causade la contraccin. Se estima que el efecto del rigor decongelacin, o encogimiento en fro como tambin sedenomina, puede causar un aumento de cuatro a cincoveces en la dureza de la carne (Zaglul 1983).
El empacado es probablemente el paso ms impor-tante al preparar la carne para ser congelada (Kramlichet al. 1984). Durante la congelacin, la evaporacin dela humedad presente en la superficie de la carne puedeprovocar un serio deterioro del producto si el mismo nose encuentra debidamente protegido por un empaqueimpermeable al agua (American Meat Institute Founda-tion 1960). La deshidratacin resultante en la superfi-cie expuesta provoca el fenmeno conocido comoquemadura del hielo o freezer burn, el cual se ma-nifiesta en zonas de apariencia oscura y textura spera,registrndose prdidas de sabor y nutrientes en casosextremos (American Meat Institute Foundation 1960;Levie 1979; Kramlich et al. 1984; Frazier et al. 1985;Food Safety and Inspection Service 1999). El proble-ma de la quemadura del hielo es no obstante un proble-ma de calidad pero no de seguridad (Food Safety andInspection Service 1999). Es importante que el empa-que se encuentre adherido al contorno de la pieza, pueslos espacios dentro del empaque igualmente dejan lasuperficie expuesta (Levie 1979; Kramlich et al. 1984).Esto hace muy recomendable el empaque al vaco (Le-vie 1979).
La velocidad con la cual una pieza de carne se con-gela puede o no estar relacionada con cambios fsicos yqumicos relacionados con la integridad de las fibrasmusculares. Cuando la congelacin es rpida, los cris-tales de hielo formados son pequeos y se forman den-tro de las fibras musculares; cuando la congelacin eslenta los cristales son grandes y muchos se forman en elexterior de las fibras y en el tejido conectivo (AmericanMeat Institute Foundation 1960; Levie 1979; Food Sa-fety and Inspection Service 1999). No obstante, andurante las condiciones de congelacin ms rpida, so-lamente los pocos milmetros correspondientes a las ca-pas ms exteriores de la pieza de carne se congelan muyrpidamente por lo cual la mayor parte de los cristalesson extracelulares (American Meat Institute Founda-tion 1960; Price et al. 1976). Adems, debido a las con-diciones de almacenaje congelado propias de la indus-tria, muchos de los cristales, an los ms pequeos,crecen lentamente durante el almacenamiento (Jasper etal. 1978; Levie 1979). Con base a lo anteriormente ex-puesto, muchas autoridades han coincidido en afirmarque existe muy poco o ningn dao mecnico en las fi-bras musculares an durante la congelacin lenta(American Meat Institute Foundation 1960; Levie1979).
El congelamiento rpido, por otra parte, podra re-sultar conveniente desde un punto de vista de seguridadmicrobiolgica y de costos. La congelacin lenta favo-rece el desarrollo de microorganismos en la superficiede la carne que pueden comprometer la calidad y la se-guridad del producto (American Meat Institute Founda-tion 1960; Kramlich et al. 1984; Frazier et al. 1985; Je-remiah 1999). La congelacin rpida es de primordialimportancia en carnes precocidas, dado que al haber si-do sometidas las mismas a un proceso trmico presen-tan una carga microbiana muy baja (Jeremiah 1999). Sise llega a presentar una recontaminacin, los microor-ganismos as inoculados tendran muy poca competen-cia, adems de un excelente medio de cultivo (Frazieret al. 1985). El proceso de congelacin rpida en tnel,supone tambin un considerable ahorro de espacio encontra del congelado lento dentro de una cmara decongelacin (Pohlman 1971).
La congelacin correctamente ejecutada, no tieneefectos mayores sobre el color, sabor, olor y la jugosi-dad de la carne aun despus de varios meses (AmericanMeat Institute Foundation 1960; Food Safety and Ins-pection Service 1999). Estos efectos se reducen consi-derablemente si se emplea el empacado al vaco (Fa-rouk et al. 1998). Los cristales formados tienen poco oningn efecto sobre la suavidad de la carne, aunque laexpansin del tejido conectivo registrado durante lacongelacin puede tener algn efecto mecnico que in-cremente la suavidad (Levie 1979). No existe eviden-cia de que la congelacin despus resuelto el rigor cau-se un incremento de la dureza en la carne, excepto enaquellas regiones donde se registren extensivas quema-duras del hielo (Levie 1979).
La congelacin del msculo bovino tiene un efectodesnaturalizante en las protenas miofibrilares (Wagneret al. 1985). Se dan efectos considerables en la solubi-lidad y en las caractersticas termofsicas de estas prote-nas, las cuales son ms marcadas entre mayor sea el pe-rodo previo a la congelacin (Farias et al. 1989).Muchas de estas modificaciones irreversibles se dan aconsecuencia de las altas concentraciones transitorias desales que se registran durante el proceso de congelacin,especialmente cuando el mismo es excesivamente lento(Belitz et al. 1985; Frazier et al. 1985; Petrovic et al.1993). La desnaturalizacin, resultado del desdobla-miento de la cabeza de la miosina (Wagner et al. 1985),est relacionada con una baja en la capacidad de reten-cin de agua del msculo (Jasper et al. 1978). Dada ladesnaturalizacin, durante la congelacin las interaccio-nes agua-protena son remplazadas por interaccionesprotena-protena y se disminuye la capacidad para ligarel agua (Wagner et al. 1985). Las prdidas que se gene-ran por esta razn al descongelar pueden ser significati-vas si no se sigui un adecuado proceso de congelacin,
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 237
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
no obstante, si el proceso fue exitoso estas prdidas tie-nen poco efecto sobre la jugosidad (Levie 1979).
Es posible que muy poca actividad enzimtica con-tine durante el almacenamiento congelado, dndosecierto nivel de protelisis y por lo tanto una leve mejoraen la suavidad (Levie 1979). Durante la congelacin,las calpanas no son considerablemente destruidas y re-tienen su actividad despus de efectuarse la descongela-cin; no obstante, no son activas en estado de congela-cin (Duckett 1999) y su accin es muy limitada encarnes que experimenten el fenmeno del rigor de con-gelacin (Zamora et al. 1998). Por otro lado, la calpas-tatina es especialmente sensible a la congelacin y susniveles de actividad decrecen muy significativamentedurante el proceso (Whipple et al. 1992; Kim et al.1997; Duckett et al. 1998; Duckett 1999).
La calidad final de la carne congelada no dependesolamente de como se efecta la congelacin, sino tam-bin del mtodo empleado durante la descongelacin(Jasper et al. 1978). La descongelacin a temperaturaambiente est fuertemente contraindicada debido al al-to riesgo microbiolgico asociado (Food Safety AndInspection Service 1999; College of Agriculture of theFort Valley State University 1999). El mtodo msconveniente de descongelamiento en trminos de la du-reza final y de seguridad, es aquel que se lleva a caboprogresivamente en cmaras con movimiento de aire atemperaturas de refrigeracin (Ambrosiadis et al. 1994;Sorowka 1995). A pesar de que este mtodo produceeventualmente algunas prdidas de fludos, es el quegenera una mayor suavidad final cuando sta se midepor medios sensoriales e instrumentales (Ambrosiadiset al. 1994).
LITERATURA CITADA
ABBA. 1998. Genetic signs of beef tenderness (en lnea).Consultado 18 octubre 1998. Disponible: http://brah-mans.com/Bjhomepage/Bjcov9810/bjtab9810/bj-fea9810/bjfea9810_01/bjfea9810_01.html
ALARCN, A.D.; DRANSFIELD, A.D. 1995. Alteration ofpost-mortem ageing in beef by the addition of enzymeinhibitors and activators. Meat Science 41(2): 163-178.
AMBROSIADIS, I.; THEODORAKAKOS, N.; GEORGA-KIS, S.; LEKKAS, S. 1994. Effects of thawing met-hods on quality of frozen meat and drip loss. Fleisch-wirstschaft 74(3): 320, 323-325.
AMERICAN MEAT INSTITUTE FOUNDATION. 1960.The science of meat and meat products. San Francisco,California. Ed. W.H. Freeman and Company. 200p.
ASHIE, I.; SIMPSON, B.K. 1997. Proteolysis in foodmyosystems. Journal of food Biochemistry 21(2): 91-123.
BAYLISS, P. 1995. Chemistry in the kitchen: the chemistryof flesh foods II. Nutrition and Food Science 2: 21-26.
BAKI, A.; TOMPA, P.; ALEXA, A.; MOLNR, O.; FRIE-DRICH, P. 1996. Autolysis parallels activation of-calpain. Biochem. J. 318: 897-901.
BARBUT, S.; KAKUDA, Y; CHAN, D. 1990. Effects ofcarbon dioxide, freezing and vacuum packaging on theoxidative stability of mechanically deboned poultrymeat. Poultry Science 69(10): 1813-1815.
BECHEREL, F. 1991. Keeping quality of horse meat in com-mercial distribution. Viandes et Produits. Carnes 12(1):21-27.
BELITZ, H.W.; GROSCH, W. 1985. Qumica de los alimen-tos. Zaragoza, Espaa. Ed. Acribia. 813 p.
BELTRN, J.A.; JAIME, I.; SANTOLARIA, P.; SANUDO,C.; ALBERTI, P.; RONCALES, P. 1997. Effect ofstress induced high post mortem pH on protease acti-vity and tenderness of beef. Meat Science 45(2): 201-207.
BERGE, P.; CULIOLI, J.; OUALI, A. 1993. Performance,muscle composition and meat texture in veal calves ad-ministered a beta agonist (clenbuterol). Meat Science33(2): 191-206.
BISHOP, S.; OLSEN, C.; BULLOCH, S. 1999. B.O.Bs gly-colysis, Krebs cycle and electron transport chain pages(en lnea). Consultado [14 febrero 1999]. Disponibleh t t p : / / w w w. g e o c i t i e s . c o m / C a p e C a n a v e r a l /Lab/2041/glycoinfo.htm
BOEHM, M.L.; KENDALL, T.L.; THOMPSON, V.F.;GOLL, D.E. 1998. Changes in the calpains and cal-pastatin during postmortem storage of bovine muscle.Journal of Animal Science 76(9): 2415-2434.
BOERS, R.H. 1988. Intrinsic and extrinsic factors in relationto the microbiological quality of vacuum packagedfresh meat. Voedingsnliddelentechnologie 21(21): 55-57.
BRITISH NUTRITION FUNDATION. 1988. Facts on meat(en lnea). Consultado 15 enero 1999. Disponible:http://nutrition.org.uk/Facts/commodities/meat.html
BRUCE, H.L.; BALL, R. 1990. Effects of postmortem gly-colysis on the quality of hot deboned bovine muscle.Canadian Journal of Animal Science 70(2): 431-439.
BUTS, B.; CLAEYS, E.; DEMEYER, D. 1987. Protein frag-mentation and meat tenderness. Mededelingen Van deFaculteit Landbouwwetenschappen RijksuniversiteitGent 52 (4): 1529-1538.
238
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
CaBP DATA LIBRARY. 1999. Calpain (en lnea). Consultado10 marzo 1999. Disponible en: http://www.scripps.e-du/~mnelson/database/general/prot_pages/calpain.html
CAMPO, M.M.; SANUDO, C.; PANEA, B.; ALBERTI, P.;SANTOLARIA, P. 1999. Breed type and ageing timeeffects on sensory characteristics of beef strip loinsteaks. Meat Science 51 (4): 383-390.
CHOMON, P. 1987. Pre-cooked meats under modified at-mosphere with radically increased shelf life. In Procee-dings of the First International Conference on Packa-ging Advances. p. 187-191.
CHOW, H.M. 1996. Structural changes of myofibrils affec-ted by endogenous proteases during postmortem aging.Taiwan Sugar 43 (1): 23-26.
CLARE, T.L.; JACKSON, S.P.; MILLER, M.F.; ELLIOT,C.T.; RAMSEY, C.B. 1997. Improving tenderness ofnormal and callipyge lambs with calcium chlorine.Journal of Animal Science 75: 377-385.
COLE, D.J.A.; LAWRIE, R.A. 1975. Meat. Connecticut,E.E.U.U. Ed. AVI. 596 p.
COLLEGE OF AGRICULTURE OF THE FORT VALLEYSTATE UNIVERSITY. 1999. Freezing and thawingmeat products (en lnea). Consultado 17 febrero 1999.Disponible en: http://www.ag.fvsu.edu/html/publica-tions/teletips/food_preservation_and_storage/1401.htm
COSTELL, E. 1992. Influencia del envase en la aceptabili-dad de los alimentos. Revista Espaola de Ciencia yTecnologa de Alimentos 32(5): 493-507.
CRIDGE, A.G.; BICKERSTAFFE, R.; COWLEY, R.; SAVA-GE, G.P. 1994. Post-mortem factors influencing thequality of beef. In Proceedings of the Nutrition Societyof New Zealand p. 93-100.
DAYTON, W.R.; SCHOLLMEYER, J.V. 1981. Immunocy-tochemical localization of calcium activated protease inskeletal muscle cell. Experimental Cell Research 136:423-433.
DOUMIT, M.; KOOHMARAIE, M. 1999. Inmunoblot analy-sis of calpastatin degradation: evidence for cleavage bycalpain in postmortem muscle (en lnea). Consultado15 enero 1999. Disponible en: http://www.nal.us-da.gov/ttic/tektran/data/
DRANSFIELD, E. 1994. Optimization of tenderization,aging and tenderness. Meat Science 36(1-2): 105-121.
DRANSFIELD, E. 1996. Calpains from thaw rigor muscle.Meat Science 43(3,4): 311-320.
DRANSFIELD, E.; ETHERINGTON, D.J.; TAYLOR, M.A.1992. Modeling postmortem tenderization II: enzyme
changes during storage of electrically stimulated andnon stimulated beef. Meat Science 31(1): 75-84.
DUCKETT, S.; KLEIN, T.A.; THORNGATE, J.H.; BUS-BOOM, J.R.; SNOWDER, G.D. 1998. Effect of free-zing on calpastatin activity and tenderness of callipygelamb. Journal of Animal Science 76: 1869-1874.
DUCKETT, S. 1999. Efectos de la coccin y la congelacinsobre las calpanas. World Wide Web, San Jos. Comu-nicacin Personal.
EISEMANN, J.H. 1996. Impact of beta-adrenergic agoniston growth and metabolism of meat animals. In Procee-dings of the Scientific Conference on Growth Promo-tion in Meat Production p. 121-150.
ELCE, J.S.; HEGADORN, C.; ARTHUR, J.S.C. 1997. Au-tolysis, Ca2+ requirement, and heterodimer stability inm-calpain. Journal of Biological Chemistry 272(17):11268-11275.
EPLEY, R.J. 1992. Meat tenderness (en lnea). Consultado16 diciembre 1998. Disponible en: http://www.exten-sion.umn.edu/Documents/D/J/DJ0856.html
FARIAS, G.; OUALI, A.; BONNET, M.; KOPP, J. 1989. Ef-fects of freezing on some characteristics of muscle tis-sue, and consequences for maturation of meat. Viandeset Produits Carnes 10(4): 141-148.
FAROUK, M.N.; SWAN, J.E. 1998. Effect of muscle condi-tion before freezing and stimulated chemical changesduring frozen storage on the pH and colour of beef.Meat Science 50(2): 245-256.
FIELD, R.; McCORMICK, R.; BALASUBRAMANIA, V.;SANSO, D.; WISE, J.; HIXON, D.; RILEY, M.; RUS-SEL, W. 1997. Tenderness variation among loin steaksfrom A and C maturity carcasses of beifers similar inchronological age. Journal of Animal Science 75(3):693-699.
FOEGEDING, E.A.; LIU, M.N. 1995. Functional differen-ces of myofibrillar proteins from fast and slow twitchmuscles. Journal of Muscle Foods 6(2): 109-123.
FOOD SAFETY AND INSPECTION SERVICE. 1999. Fo-cus on freezing (en lnea). Consultado febrero 20 1999.Disponible en: http://www.fsis.usda.gov/OA/pubs/free-zing.htm
FRAZIER, W.C.; WESTHOFF, D.C. 1985. Microbiologade los alimentos. Tercera edicin. Zaragoza, Espaa.Ed. Acribia. 522 p.
GEESINK, G.; KOOLMEES, P.A.; LAACK, H.; SMUL-DERS, F. 1995. Determinants of tenderization in beeflongissimus dorsi and triceps brachii muscles. MeatScience 41(1): 7-17.
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 239
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
GEESINK, G.; KOOHMARAIE, M. 1998. Effect of calpas-tatin on degradation of miofibrillar proteins by U-cal-pain under postmortem conditions (en lnea). Consul-tado 25 enero 1999. Disponible en: http://www.nal.usda.gov/ttic/tektran/data/
GEESINK, G.; KOOHMARAIE, M. 1999. Postmortem Pro-teolysis and calpain calpastantin activity in callipyge andnormal lamb biceps femoris during extended postmortemstorage. Journal Of Animal Science 77: 1490-1501.
GIL, M., HORTOS, M.; SARRAGA, C. 1998. Calpain andcathepsin activities, and protein extractability duringageing of ilongissimusi porcine muscle from normaland PSE meat. Food Chemistry 63(3): 385-390.
GILCHRIST, J.S.C. 1999. Identification and purification ofnuclear calcium binding proteins (en lnea). Consulta-do 10 marzo 1999. Disponible en: http://www.umanito-ba.ca/faculties/dentistry/OralBio/gilchris.html
GOLL, D.E. 1997. The Ca++ dependent protease system (enlnea). Consultado [16 noviembre de 1998]. Disponi-ble en: http://www.biochem.arizona.edu/classes/bio-c496A/gollsumm.html
GOLL, D.E.; DAYTON, W.R; INDERJIT, S.; ROBSON,R.M. 1991. Studies of the alpha actinin/actin interac-tion in the Z disk by using calpain. Journal of Biologi-cal Chemistry 266(13): 8501-8510.
GOLL, D.E.; THOMPSON, V.F.; TAYLOR, R.G.; ZELEWS-KA, T. 1992. Is calpain activity regulated by membra-nes and autolysis or by calcium and calpastatin? .BioEssays 14(8): 549-556.
GOLL, D.E.; TAYLOR, R.G; OUALI, A.; CHOU, R.R. 1999.The calpain system in muscle tissue. In Calpain: Phar-macology and Toxicology of Calcium Dependent Pro-tease. Taylor and Francis. Estados Unidos de Amrica.
GOLOVKIN, N.A.; IVANOVA, R.; SHAROBAIKO, V.; VO-ROBEVA, N. 1984. Changes in meat tenderness du-ring storage. In: Proceedings of the European Meetingof Meat Research Workers 30: 4-20.
GORDON, A.M; HOMSHER, E.; REIGNIER, M. 2000. Re-gulation of contraction in stried muscle. PhysiologicalRewiews 80 (2): 854-924.
GOT, F.; RUSSET-AKRIM, S.; BAYLE, M.C.; CULIOLI, J.1996. Effects of calcium lactate on tenderness and fla-vour of beef. Viandes et Produits Carnes 17(6): 328-330.
HAHN-JUN, L.; SORIMACHI, H.; SEON-YONG, J.; IS-HIURA, S.; SUZUKI, K. Molecular cloning and cha-racterization of a novel tissue-specific calpain predomi-nantly expressed in the digestive tract. BiologicalChemistry 379: 175-183.
HEINZE, P.H.; BRUGGEMANN, D. 1994. Ageing of beef:influence of two ageing methods on sensory propertiesand myofibrillar proteins. Sciences des Aliments14(4): 387-399
HONIKEL, K.O.; SEUSS, I. 1988. Preparation and tender-ness of meat. Mitteilungsblatt der Bundesanstalt fuerFleischforschung Kulmbach (100): 7926-7932.
HORTOS, M.; GIL, M.; SARRAGA, C. 1994. Effect of cal-pain and cathepsin activities on myofibrils from porcinelongissimus muscle during conditioning of normal andexudative meat. Sciences des Aliments 14(4): 503-515.
HUANG, J.; FORSBERG, N.E. 1998. Role of calpain inskeletal-muscle protein degradation. In: Proceedingsof the National Academy of Sciences of the United Sta-tes of America 95(21): 12100-12105.
HULTIN, H.O.; FENG, Y.; STANLEY, D.W. 1995. A re-exa-mination of muscle protein solubility. Journal of Mus-cle Foods 6(2): 91-107.
JAMIESON, M.; JOBBER, P. 1974. Manejo de los alimen-tos. Distriro Federal, Mxico. Ed. Pax-Mxico. 131p.
JASPER, W.; PLACZEK, R. 1978. Conservacin de la car-ne por el fro. Zaragoza, Espaa. Ed. Acribia. 131p.
JEREMIAH, L.E.; BEAUCHEMIN, K.A.; JONES, S.D.M.;GIBSON, L.L.; RODE, L.M. 1998. The influence ofdietary cereal grain source and feed enzymes on thecooking properties and palatability attributes of beef.Canadian Journal of Animal Science 78(3): 271-275
JEREMIAH, L.E. 1999. Consideraciones microbiolgicassobre la coccin al vaco. World Wide Web, San Jos.Comunicacin personal.
JONES, S.; JEREMIAH, L.E.; TONG, A.; LUTZ, S.; RO-BERTSON W.M. 1991. The effects of marbling level,electrical stimulation, and post mortem aging on the coo-king and palatability properties of beef rib-eye steaks.Canadian Journal of Animal Science 71(4): 1037-1043
KAWASHIMA, S.; AKANUMA, H.; ASAOKA, K. 1998.Comparison of calpains from rabbit, monkey, humanand rat. Current Contests ISSN: 1431-6730
KIM, K.H.; KIM, Y.S. 1997. The effects of sample storageand handling condition on calpain II and II and calpas-tatin activities in skeletal muscles. Korean Journal ofAnimal Science 39(5): 617-624.
KINBARA, Y.; SORIMACHI, H.; ISHIURA, S.; SUSUKI,K. 1998. Skeletal muscle specific Calpain p94. Bio-chemical Pharmacology 56(4): 415-420.
KNECHT, E. 1997. Protelisis (en lnea). Consultado 16 di-ciembre 1998. Disponible en: http://www.ochoa.fi-b.esp/memoria/res_lab_bio_cel.htm
240
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
KOOHMARAIE, M. 1992. The role of Ca2+ dependent pro-teases (calpains) in post mortem proteolysis and meattenderness. Biochimie 74(3): 239-245.
KOOHMARAIE, M. 1994. Muscle proteinases and meataging. Meat Science 36 (1/2): 93-104.
KRAMLICH, W.E.; PEARSON, A.M.; TAUBER, F.W. 1984.Processed meats. New York, New York. Ed. Avi. 348 p.
KUMAMOTO, T.; KLEESE, W.C.; CONG, J.; GOLL, D.E.;PIERCE, P.R.; ALLEN, R.E. 1992. Localization of theCa2+ dependent proteinases and their inhibitor in nor-mal, fasted, and denervated rat skeletal muscle. ActaNeuropathologia 32(5): 493-507.
LEVIE, A. 1974. Meat handbook. Connecticut, E.E.U.U. Ed.Avi. 300 p.
LIBBY, J. 1986. Higiene de la carne. Distrito Federal, Mxi-co. Ed.CECSA. 659 p.
LOURDES, M.; ESCALONA, H.; GUERRERO, I. 1998. Ef-fect of calcium chloride marination on calpain and qua-lity characteristics of meat from chicken, horse, cattleand rabbit. Meat, Poultry and Game 48(1-2): 125-134.
MILLIGAN, S.D.; MILLER, M.F.; OATS, C.N.; RAMSEY,C.B. 1997. Calcium chlorine injection and degree ofdoneness effects on the sensory characteristics of beefinside round roasts (en lnea). Consultado 17 diciembre1999. Disponible en: http://www.asas.org/jas/abs/1997/mar668abs.html
MILLS, F.W.; COMERFORD, J.W.; HOLLENDER, R.;HARPSTER, H.W.; HOUSE, B.; HENNING, W.R.1992. Meat composition and palatability of Holsteinand beef steers as influenced by forage type and proteinsource. Journal of Animal Science 70(8): 2446-2451.
MUELLER, W. 1990. Improvement of the tenderness ofroosting meat by mechanical treatment. Mitteilungs-blatt der Bundesanstalt fuer Fleischforschung Kulm-bach (107): 24-28.
MUELLER, S. 1990. Packaging and meat quality. CanadianInstitute of Food Science and Technology Journal23(1): 22-25.
MURRAY, R; GRANNER, D; MAYES, P.; RODWELL, V.1990. Bioqumica de Harper. 22 edicin. MxicoD.F., Mxico. Ed. Manual Moderno. 740 p.
NISHIMURA, T.; HATTORI, A.; TAKAHASHI, K. 1999.Structural changes in intramuscular connective tissueduring the fattening of japanese black cattle: effect ofmarbling on beef tenderization. Journal of AnimalScience 77: 93-104.
OHALLORAN, G.R.; TROY, D.J.; BUCKLEY, D.J.; REVI-LLE, W.J. 1997. The role of endogenous proteases in
the tenderization of fast glycolysing muscle. MeatScience 47(3/4): 187-210.
ONO, Y.; SHIMADA, H.; SORIMACHI, H.; RICHARD, I.;SAIDO, T.C.; BECKMANN, J.S.; ISHICURA, S.; SU-SUKI, K. 1997. Functional defects of a muscle speci-fic Calpain, p94, caused by mutations associated withLimb-Girdle muscular dystrophy type 2A. Journal ofBiological Chemistry 273(27): 17073-17078.
ONO, Y.; SORIMACHI, H.; SUSUKI, K. 1998. Structureand physiology of calpain, an enigmatic protease. Bio-chemical and Biophysical Research Communications245: 289-294.
OUALI, A. 1990. Meat tenderization: possible causes andmechanisms. Journal of Muscle Foods 1(2): 129-165.
OUALI, A. 1992. Proteolytic and physicochemical mecha-nisms involved in meat texture development. Biochi-mie 74(3): 251-265.
PARR, T.; SENSKY, P.L.; SCOTHERN, G.P.; BARDSLEY,R.G.; BUTTERY, P.J.; WOOD, J.D.; WARKUP, C. 1997.Relationship between skeletal muscle specific calpainand tenderness of conditioned porcine longissimus mus-cle (en lnea). Consultado 19 diciembre 1999. Disponibleen: http://www.asas.org/jas/abs/1999/mar661. html
PARRISH, F.C. 1999. Aging of beef (en lnea). Consultado21 enero 1999. Disponible en: http://www.beef.org-/8010/ beef/librpub/pcrifact/aging.htm
PETROVIC, L., GRUJIC, R.; PETROVIC, M. 1993. Defi-nition of the optimal freezing rate II: investigation ofthe physicochemical properties of beef M. longissimusdorsi frozen at different freezing rates. Meat Science33(3): 319-331.
POHLMAN, W. 1971. Manual de tcnica frigorfica. Barce-lona, Espaa. Ed. Ediciones Omega. 171 p.
POTTER, N. 1978. La ciencia de los alimentos. Distrito Fe-deral, Mxico. Ed EDUTEX. 749 p.
PRICE, J.F.; SCHWEIGERT, B.S. 1976. Ciencia de la carney de los productos crnicos. Acribia. Zaragoza. 450 p.
PRIGGE, J.T.; KIRKPATRICK-KELLER, D.C.; KILLEFER,J. 1998. Isolation and characterization of a calpain ac-tivator in chicken skeletal muscle. Poultry Science 77:1411-1416
PRINGLE, T.; WILLIAMS, S.; JOHNSON, D.; WEST, L.1996. The role of the calpain proteinase system in agedtenderness of angus and brahman crossbred steers (enlnea). Consultado 8 setiembre 1998. Disponiblehttp://www.ads.uga.edu/annrpt/1996/96_039.htm
PURCHAS, R.W.; AUNGSUPAKORN, R. 1993. Further in-vestigations into the relationship between ultimate pH
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE 241
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
CHACN: IMPLICACIONES FSICAS Y BIOQUMICAS DE LA SUAVIDAD DE LA CARNE
and tenderness for beef samples from bulls and steers.Meat Science 34(2): 163-178.
RODRGUEZ, T. 1986. Efecto de la estimulacin elctricaen la suavidad de la carne bovina. Tesis Lic. en Tecno-loga de Alimentos. Universidad de Costa Rica, Carre-ra Interdisciplinaria en Tecnologa de Alimentos. SanJos.
SAVELL, J. 1998. Meat tenderization (en lnea). Consulta-do [15 enero 1999]. Disponible en: http://savel-j.ta-mu.edu/tender.html
SHANNON, J.D.; GOLL, D.E. 1985. Properties of a proteinthat is purified from bovine skeletal muscle that inhibitsthe Ca2+ dependent proteinase. In Intracellular ProteinCatabolism. Alan R. Liss. New York.
SHAY, B.; EGAN A.F. 1987. The packaging of chilled redmeats. Food Technology in Australia 39(6): 283-285.
SIMMONS, N.J.; YOUNG, O.A.; DOBBIE, P.M.; SINGH,K.; THOMPSOM, B.C.; SPECK, P.A. 1997. Post-mortem calpain system kinetics in lamb: effects ofclenbuterol and preslaughter exercise. Meat Science47(1/2): 135-146.
SINCLAIR, K.D.; CUTHBERTSON, A.; RUTTER, A.;FRANKLIN, M.F. 1998. The effects of age at slaugh-ter, genotype and finishing system on the organolepticproperties and texture of bull beef from suckled calves.Animal Science 66(2): 329-340.
SMITH, T. 1997. The beef tenderness challenge continues(en lnea). Consultado 26 enero 1999. Disponible en:http://www.angus.org/journal/97_03mar/tender.htm
SOLS, E. 1999. Suavizamiento por inyeccin de cloruro decalcio y discusin de mtodos de anlisis implementa-dos en el laboratorio de control de calidad de Coope-montecillos RL. Alajuela, Costa Rica. ComunicacinPersonal.
SORIMACHI, H.; ISHIURA, S.; SUSUKI, K. 1997. Struc-ture and physiological function of calpains. Biochemi-cal Journal 328: 721-732
SORIMACHI, H. 1999. Discusin sobre generalidades delas calpanas. World Wide Web, San Jos. Comunica-cin Personal.
SOU, S.; KOIKE, H.; SORIMACHI, H.; ISHIURA, S.; SU-ZUKI, K. 1999. Association and dissociation of thecalcium-binding domains of calpain by Ca2+. Bioche-mical and Biophysical Research Communications257(1): 63-66.
SPARAKOWSKI, W. 1991. A new process is successful:packaging of perishable products. Fleischerei 42(12):975-976.
SPECK, P.A; COLLINGWOOD, K.M.; BARDSLEY, R.G.;TUCKER, G.A.; GILMOUR, R.S.; BUTTERY, P.J.1993. Transient changes in growth and in calpain andcalpastantin expression in ovine skeletal muscle aftershort-term dietary inclusion of cimaterol. Biochimie75(10): 917-923.
SPENCER, M.J.; TIDBALL, J.G. 1992. Calpain concentra-tion is elevated although net calcium dependent pro-teolysis is supressed in dystrophin deficient muscle.Experimental Cell Research 203: 493-507.
STANTON, C. 1989. Proteolysis induced changes in meatcollagen during conditioning. Dissertation AbstractsInternational 49(12): 5084-5085.
SUROWKA, K. 1995. Microwave thawing of meat compa-red with conventional methods. Chlodnictwo 30(11):25-28.
SUZUKI, A.; WATANABE, M.; IKEUCHI, Y.; SAITO, M.;TAKAHASHI, K. 1993. Effects of high-pressure treat-ment on the ultra structure and thermal behavior of beefintramuscular collagen. Meat Science 35(1): 17-25.
SUZUKI, K.; SORIMACHI, H. 1998. A novel aspect of cal-pain activation. FEBS Letters 433:1-4
SUZUKI, K. 1999. Discusin sobre generalidades de las cal-panas. World Wide Web, San Jos. ComunicacinPersonal.
SWATLAND, H.J. 1999. Growth & structure of meat animals(en lnea). Consultado 10 enero 1999. Disponible.http://www.aps.uoguelph.ca/~swatland/gasman.html
SWATLAND, H.J. 1998. Contraction, rigor and conditio-ning (en lnea). Consultado 10 enero 1999. Disponibleen: http://www.aps.ouguelph.ca/swatland/html/ch5.1.html
SWATLAND, H.J.; FINDLAY, C.J. 1997. On-line predictionof beef toughness, correlating sensory evaluation withfluorescence of connective tissue and dynamic analysisof overall toughness. Food Quality and Preference8(3): 233-239.
TAKAHASHI, K. 1992. Non enzymatic weakening of myo-fibrillar structures during conditioning of meat: cal-cium ions at 0.1 mM and their effect on meat tenderiza-tion. Biochimie 74(3): 247-250.
TAYLOR, R.; GEESINK, G.H.; THOMPSON, V.F.; KOOH-MARAIE, M.; GOLL, D.E. 1995. Is Z-disk degrada-tion responsible for postmortem tenderization? Journalof Animal Science 73(5): 1351-1367.
TAYLOR, R.; KOOHMARAIE. 1998. Effects of postmor-tem storage on the ultrastructure of the endomysiumand myofibrils in normal and callipyge longissimus.Journal of Animal Science 76: 2811-2817.
242
AGRONOMA MESOAMERICANA 15(2): 225-243. 2004
-
TEXAS A&M UNIVERSITY. 1999. Meat tenderness (en l-nea). Consultado 11 enero 1999. Disponible http://www.meat.tamu.edu/tender.html
THOMSON, B.C.; DOBBIE, P.M.; SINGH, K.; SPECK, P.A.1996. Postmortem kinetics of meat tenderness and thecomponents of the calpain system in bull skeletal mus-cles. Meat Science 44(3): 151-157.
THOMSON, B.C.; DOBBIE, P.M. 1997. The effect of cal-cium chlorine treatment on shear force and weight lossin gluteus medius and longissimus muscles from pastu-re fed bulls. New Zealand Journal of Agricultural Re-search 40(4): 507-512.
TOMPA, P.; BAKI, A.; SCHAD, E.; FRIEDRICH, P. 1996.The calpain cascade: -calpain activates m-calpain.Journal of Biological Chemistry 271(52): 33161-33164.
TROY, D. 1994. Tenderizing beef (en lnea). Consultado 19enero 1999. Disponible en: http://exp.interspeed.net/flai/ffe11994.htm
UNIVERSIDAD AUTNOMA DE BARCELONA. 1999.El papel de la ceramida y las caspasas en la muerte neu-ronal apopttica que ocurre en los procesos de hipoglu-cemia e hipoxia en el sistema nervioso central (en l-nea). Consultado 19 ferbrero 1999. Disponible en:http://cc.uab.es/~ikbq1/isquemia.html
UYTTERHAEGEN, L.; CLAEYS, E.; DEMEYER, D. 1992.The effects of electrical stimulation on beef tenderness,protease activity and myofibrillar protein fragmenta-tion. Biochimie 74(3): 275-2281.
UYTTERHAEGEN, L.; CLAEYS, E.; DEMEYER, D. 1994.Effects of exogenous protease effectors on beef tender-ness development and myofibrillar degradation and so-lubility. Journal of Animal Science 72(5): 1209-1223.
VOISINET, B.D.; GRANDIN, T.; OCONNOR, S.F.; TA-TUM, J.D.; DEESING, M.J. Bos indicus-croos feedlotcattle with excitable temperaments have tougher meatand a higher incidence of borderline dark cutters. MeatScience 46(4): 367-377.
WAGNE