Guía lab. 1 POLARIDAD DE COMPUESTOS ORGÁNICOS (1)
-
Upload
alejandra-noemi-parra-silva -
Category
Documents
-
view
32 -
download
0
Transcript of Guía lab. 1 POLARIDAD DE COMPUESTOS ORGÁNICOS (1)

1. APRENDIZAJES ESPERADOS: De acuerdo al descriptor de asignatura.
- Realizar trabajo experimental acerca de teoría de solubilidad de compuestos
orgánicos
- Reconocer diferencias de solubilidad según naturaleza de compuestos.
- Aplicar técnica de diferencia de solubilidad para separación o purificación de
compuestos.
- Elaborar informe respecto de los temas tratados en las prácticas de laboratorio.
2. INTRODUCCIÓN / ANTECEDENTES:
Solubilidad: Es indudable que las propiedades físicas de los diversos tipos de sustancias son
una consecuencia de su estructura; el estado sólido, líquido o gaseoso, solubilidad, dureza,
conductividad térmica y eléctrica, viscosidad, etc. Están ligados a la constitución interna de
la materia. Diremos que dos o más sustancias son solubles entre sí, cuando puedan formar
una mezcla homogénea entre ellas, es decir, una solución verdadera.
Para que esto ocurra, las moléculas de las sustancias deberán intercalarse entre sí estando
esto condicionado, entre otros factores, a caracteres de enlaces similares, MIENTRAS MÁS
SEMEJANTES SEAN LOS TIPOS DE ENLACES PRESENTES EN DOS SUSTANCIAS, SU
SOLUBILIDAD SERA MAYOR.
En este trabajo práctico veremos una de estas propiedades: Solubilidad; para esto
estudiaremos el comportamiento de una serie de sustancias frente a diferentes solventes.
Purificación por Recristalización: En la mayoría de los casos, los sólidos son más solubles en
un solvente caliente que en frío. Este hecho es la base para la purificación de un sólido por
recristalización.
El sólido que va a purificar se disuelve en solvente caliente, generalmente a ebullición, la
mezcla caliente se filtra para eliminar las impurezas insolubles, existe además algunas
impurezas solubles coloreadas que pueden ser absorbidas por pequeñas cantidades de
carbón activado y ser así eliminadas en la filtración, entonces la solución se deja enfriar
para que se produzca la cristalización.
LABORATORIO DE QUÍMICA
ORGÁNICA
“POLARIDAD DE COMPUESTOS ORGÁNICOS”
Preparado por: Inés Villanueva Aprobado por: Julie Mendoza Fecha de vigencia: OTOÑO 2012
Página 1 de 4

En el caso ideal, toda la sustancia deseada, debe separarse en forma cristalina y todas las
impurezas solubles deben quedar disueltas en las aguas madres. Finalmente, los cristales se
separan por filtración al vacío y se dejan secar.
La cristalización como técnica de purificación se debe a que la ordenación de las moléculas
en una red cristalina es un proceso extraordinariamente selectivo y delicado, por lo que solo
logran formar sustancias puras.
Un disolvente apropiado deberá poseer los siguientes requisitos que:
a) A temperatura elevada disuelva rápidamente el compuesto (soluto a purificar)
b) A baja temperatura disuelva la mínima cantidad de soluto
c) No reaccione con el soluto
d) Sea lo suficientemente volátil para que sea fácil eliminarlo de los cristales
e) Disuelva una gran cantidad de impureza en frío
f) No se inflame
3. CRITERIOS DE EVALUACIÓN:
Reconoce teoría de solubilidad.
Aplica teoría de solubilidad en compuestos orgánicos.
Aplica diferencia de solubilidad para separación o purificación de compuestos.
4. MATERIALES / EQUIPOS:
Materiales
Gotario
Batería de Tubos de ensayo
Pipetas graduadas 1ml
Gradilla
Propipetas
Pizeta
Varillas de agitación
Pinzas para tubos de ensayo
Calefactor
Campana de extracción
Vaso de precipitado
Embudo de filtración
Matraz erlenmeyer
Papel filtro
Vidrio reloj
Campana de extracción
Reactivos
Agua destilada
Éter
Acetona
Alcohol
Cloroformo
Cloruro de sodio
Naftaleno
Acido benzoico
Glucosa
Acido Salicílico
Carbón activado

5. ACTIVIDADES / DESCRIPCION DE PROCEDIMIENTOS:
Experiencia Nº1: Numere 5 tubos de ensayo, y vierta en cada uno de ellos
aproximadamente 1 mL de cada uno de los siguientes solventes como a continuación se
indica:
Agregue a cada uno de ellos, una punta de espátula de Cloruro de Sodio, agite
vigorosamente; si la sustancia es insoluble en frío, se calienta el conjunto (en Baño María sí
se trata de solventes inflamables).
Observe y anote los resultados en el cuadro de solubilidad. Repita el proceso usando las
siguientes sustancias: Naftaleno, Ácido Benzoico, Glucosa y Ácido Salicílico.
Agua
1
Acetona
2
Éter
3
Alcohol
4
Cloroformo
5
Soluto
NaCl
Naftaleno
Ác. Benzoico
Glucosa
Ác. Salicílico
Use la siguiente nomenclatura para completar este cuadro:
+ Soluble
Insoluble
Más o menos insoluble
Experiencia Nº2
La muestra a purificar (aprox. 3 g) colóquela en un vaso de pp., agregue la cantidad de
disolvente necesario para alcanzar la solubilidad total de la muestra, esto es aprox. 100 mL
calentando y agitando constantemente para acelerar la disolución. Una vez disuelto agregue
carbón activado (una punta de espátula), calentando unos 2 minutos. Filtre en caliente a
través de un embudo analítico de vástago corto y utilice papel filtro plegado, reciba el
filtrado y deje enfriar en un baño de agua (en lo posible hielo).
Finalmente filtre al vacío los cristales obtenidos, lávelos 2 ó 3 veces con el solvente utilizado
y colóquelos en un vidrio de reloj para secar.
Tubo Nº 1 2 3 4 5
Solvente Agua Acetona Éter Alcohol Cloroformo

6. EVALUACIÓN:
Para cada experiencia; registre sus observaciones y averigüe en bibliografía la
reacción química correspondiente.
Explicar la solubilidad observada de los compuestos utilizados.
Entregar informe con lo solicitado.
Cuestionario
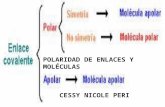
1) ¿Qué significa polaridad de enlace y qué influencia tiene en la solubilidad?
2) ¿Cuántos métodos de filtración conoce y en qué casos los aplicaría?
3) ¿En qué consiste una cristalización?
4) ¿Cuál es la finalidad de agregar carbón activado en un proceso de recristalización?
7. BIBLIOGRAFÍA
Carey, F. Química Orgánica. Tercera Edición. Madrid. McGraw-Hill. 1999.
Solomons, T. W. G. Fundamentos de Química Orgánica. Editorial Limusa. (1995).
Bailey,P.& Bailey C. Química Orgánica: Conceptos y Aplicaciones. Editorial
Pearson Education. (1998).