Vol 3 1 01-05 - euroeco.org · ción semeja a un quiste complejo. El estudio completo y el cuadro...
Transcript of Vol 3 1 01-05 - euroeco.org · ción semeja a un quiste complejo. El estudio completo y el cuadro...
EEuurrooEEccoo
RReevviissttaa ddiiggiittaall ddee EEccooggrraaffííaa CCllíínniiccaa MMaarrzzoo,, 22001122
VVoolluummeenn 33,, nnúúmmeerroo 11
Rubio Torres C, Muñoz Ruiz MA, Fuster Palacio C, Carmona Calderón M, Permanyer Barrier J, Durán Rodríguez FJ. Hidatidosis hepática.
EuroEco 2012;3(1):1-5. 1
Revisión
Hidatidosis hepática 1Carmen Rubio Torres, 1María Ángeles Muñoz Ruiz, 2Ca-milo Fuster Palacio, 3Manuel Carmona Calderón, 4Jordi Permanyer Barrier, 1Francisco Javier Durán Rodríguez 1Centro Salud de Socuéllamos (Ciudad Real)- 2Centro de Salud de Polop de la Marina (Alicante)- 3Servicio de Ra-diología. Hospital de Villanueva-Don Benito (Badajoz)- 4Clínica Diagonal. Barcelona
La hidatidosis es una enfermedad grave y destructo-
ra, cualquiera que sea su localización. El hombre actúa
como huésped intermediario y adquiere la infección me-
diante la ingestión o contacto con productos contamina-
dos por excrementos.
EPIDEMIOLOGÍA
Se trata de una zoonosis parasitaria de alta endemi-
cidad, producida por un cestodo denominado Tenia echi-nococcus.
Ningún lugar del mundo está exento de padecer la en-
fermedad; por otra parte, es una de las principales zoo-
nosis en los países desarrollados.
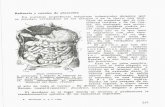
MORFOLOGÍA DEL ECHINOCUCCUS GRANULOSIS
Se trata de un cestodo pequeño. Tiene un escólex con
cuatro ventosas, un cuello delgado y corto y, a continua-
ción, le sigue la estróbila, con tres proglótides, la última
de las cuales contiene los huevos (500-800) del parásito.
En el huésped definitivo (perros domésticos y otros
cánidos) el gusano adulto mide 2-6 mm de longitud.
Los huevos (30-40 µm) son la forma infectante para el
huésped intermediario (ovejas, cerdos, ganado vacuno,
cabras, caballos…) y para otros animales que parece que
pueden tener un papel en el ciclo biológico (marsupiales,
roedores, carnívoros…). El ser humano es un huésped
accidental.
MECANISMO DE TRANSMISIÓN DEL ECHINOCUCCUS
GRANULOSIS
El hombre se infecta mediante ingestión de huevos de
equinococo eliminados en las heces por los animales
contaminados. Varios son los mecanismos:
• Por ingestión de huevos en frutas, verduras y agua
contaminadas con heces de los huéspedes definitivos
infectados.
• Por manipulación de animales infectados: los huevos
se adhieren al pelaje de los perros principalmente al-
rededor del ano, hocico, muslos y patas.
• Parece que pueden contribuir a la diseminación de
huevos el viento, las moscas y los escarabajos.
FISIOPATOLOGÍA
Una vez ingeridos, los huevos llegan hasta el intestino
delgado, donde se libera el embrión hexacanto u oncosfe-ra; éste profundiza por la pared intestinal y llega hasta la
circulación, donde es transportado hasta el hígado, que
hace de filtro. Superado el hígado a través de las venas
suprahepáticas y de la vena cava, llega hasta el corazón
derecho y, por la arteria pulmonar, alcanza los pulmones
y allí se aloja.
Por tanto, son el hígado y los pulmones los órganos
más frecuentemente afectados por el equinococo. Con
muchísima menor frecuencia puede llegar al corazón iz-
quierdo y desde ahí, por la circulación general, a otras
vísceras.
En el hígado el quiste es el resultado del atrapamien-
to de las larvas del parásito en los sinusoides hepáticos.
A ellos acceden a través del sistema portal tras ser libe-
rados de los huevos durante el tránsito digestivo. Mu-
chas se destruyen, pero otras logran enquistarse. Para
ello se produce un proceso de vacuolización tras el que
se conforma la estructura quística.
Siete días más tarde se forma la hidátide, que mide
60-70 µm; se trata de una estructura redondeada, con
vesículas en su interior. Va creciendo lentamente hasta
alcanzar los 0,5 cm de diámetro aproximadamente a los
cinco meses, y continuará haciéndolo a razón de alrede-
dor de 1 mm por mes. Ello desencadena una reacción
histológica inflamatoria parenquimatosa, con presencia
de infiltrados de fibroblastos, células gigantes mononu-
cleares y esinófilos, lo que da lugar a la capa externa o
adventicia del quiste.
MORFOESTRUCTURA DEL QUISTE HIDATÍDICO
El quiste hidatídico presenta tres capas diferenciadas,
que condicionan su desarrollo y evolución y, por tanto,
su aspecto en las imágenes generadas por los medios de
diagnóstico:
Capa externa o adventicia
Es la más externa. También se la denomina periquis-
tica. Es de carácter fibroso. No acompaña al parásito en
todos los tejidos, por lo que no se la puede considerar
como propia del quiste.
Su grosor varía con el tiempo de evolución del quiste.
En los más jóvenes se pueden distinguir dos capas: una
EEuurrooEEccoo
Rubio Torres C, Muñoz Ruiz MA, Fuster Palacio C, Carmona Calderón M, Permanyer Barrier J, Durán Rodríguez FJ. Hidatidosis hepática.
EuroEco 2012;3(1):1-5. 2
más externa de tejido de granulación, y la interna, menos
gruesa, que se adhiere a las estructuras del parásito.
Con el trascurso de los años, esta capa interna se ne-
crosa y después se calcifica parcial o totalmente.
Capa media o cutícula
La capa intermedia se denomina también membrana
laminada, cuticular o ectoquiste. Es pluriestratificada,
como en capas de cebolla.
Su grosor es de 1-2 mm. Es acelular y muy poco per-
meable. Su función es proteger al quiste de la reacción
inmunológica del huésped.
Capa interna o germinativa
Se la conoce también como prolígera o endoquiste. En
ella se secreta el líquido del quiste y además se forman
las vesículas hijas (cápsulas prolíferas), los escólex y los
ganchos. Estas se desarrollan al cabo de unos 6 meses de
iniciado el proceso
El líquido del quiste es trasparente o amarillo claro.
Contiene cloruro sódico, glucosa, iones, lípidos, polisacá-
ridos y proteínas. Puede incluir escólex y garfios y es el
responsable de la capacidad antigénica del equinococo.
DIAGNÓSTICO ECOGRÁFICO
Durante la exploración ecográfica del hígado pode-
mos encontrar lesiones ocupantes de espacio. Su conte-
nido puede ser sólido, líquido o mixto.
La exploración ecográfica presenta una sensibilidad
de 95-99% y una especificidad de 90%. Las característi-
cas ecográficas del quiste hidatídico dependen del mo-
mento evolutivo en que se encuentre su desarrollo en el
huésped. Permite precisar la localización anatómica de
las lesiones, su número, su morfología, su tamaño, su
ecoestructura y la relación con los vasos hepáticos y los
conductos biliares, y describir por tanto sus diferentes
complicaciones; también permite realizar el seguimiento
de las lesiones desde el punto de vista de la terapéutica.
Los quistes hidatídicos suelen tener un aspecto re-
dondeado o elipsoideo, de localización superficial. El de-
sarrollo de las vesículas en su interior les confiere una
apariencia ecográfica prácticamente patognomónica en
algunos momentos de su evolución.
Tabla 1. Clasificación de la OMS (WHO/IWG 2003).
CL Lesión quística unilocular sin pared visible
CE1 Lesión unilocular con pared quística visible, “areni-
lla hidatídica” y signo de “copo de nieve”.
CE2 Lesión multivesicular, multiseptada, signo del “pa-
nal de abejas” y vesículas hijas visibles.
CE3 Lesión unilocular, desprendimiento de la membra-
na laminar dentro del quiste, signo del “camalote”.
CE4 Lesión heterogénea hipo o hiperecogénica, sin vesí-
culas hijas, con contenido degenerativo.
CE5 Calcificación de la pared quística, total o parcial.
Adaptada de WHO Informal Working Group.
Acta Tropica 2003;85:253.
Se han elaborado diferentes clasificaciones en un in-
tento de sistematizar los distintos hallazgos en función
de los diferentes estadios.
La clasificación más utilizada es la clásica de Gharbi,
que organiza los hallazgos en cinco apartados. Desde
2003 la OMS ha propugnado otra que combina aspectos
evolutivos y terapéuticos (tabla 1). Autores como Lewall
establecieron de forma más simplificada otra clasifica-
ción con cuatro grupos, que no distingue entre la exis-
tencia o no de contenido sólido en el interior de los quis-
tes.
En la tabla 2 exponemos la comparación entre las dos
primeras clasificaciones citadas.
Tabla 2. Comparación entre las clasificaciones de Gharbi y de la
OMS.
Gharbi OMS Descripción
Tipo I CE1 Lesión quística unilocular anecoica con
signo de “doble línea”.
Tipo II CE3a Quiste con membranas desprendidas.
CE2 Quiste multiseptado, en “panal de abe-
ja o en “roseta”. Tipo III
CE3b Quiste con vesículas hijas en una ma-
triz sólida.
Tipo IV CE4
Quiste de contenido heterogéneo hi-
po/hiperecoico.
Sin vesículas hijas
Tipo V CE5 Lesión sólida de paredes calcificadas.
CLASIFICACIÓN DE GHARBI DE LOS QUISTES HIDATÍDICOS
Tipo I (hialino)
Es una formación unilocular con contenido líquido
puro y bordes bien definidos. Es una lesión puramente
quística, sin ecos en su interior. En ella, se observa bien
la membrana germinativa (figura 1 y vídeo 1).
Figura 1.- Quiste hidatídico Gharbi tipo I.
EEuurrooEEccoo
Rubio Torres C, Muñoz Ruiz MA, Fuster Palacio C, Carmona Calderón M, Permanyer Barrier J, Durán Rodríguez FJ. Hidatidosis hepática.
EuroEco 2012;3(1):1-5. 3
Atendiendo al grosor de la pared, se ha de realizar el
diagnóstico diferencial con el quiste seroso simple: se
cumplen los criterios ecográficos de un quiste (pared fi-
na, sin contenidos sólidos en el interior, así como los ar-
tefactos ecográficos de refuerzo acústico posterior y
sombra lateral); más difícilmente se puede apreciar al-
guna partícula de “arena hidatídica”.
VVÍÍDDEEOO 11
Tipo II (membrana desprendida)
Se observan formaciones que representan el despe-
gamiento de membranas, que se ven flotando en la cavi-
dad quística. Al haberse roto el quiste y producirse la ex-
travasación líquida al exterior, se desprenden las mem-
branas por disminución de la presión en el interior del
quiste (figura 2).
Figura 2.- Quiste hidatídico Gharbi tipo II.
Esta presentación en el parénquima hepático puede
considerarse casi patognomónica. Se le denomina tam-
bién como “signo ecográfico del nenúfar”, en compara-
ción con la radiología. Aparecen ecográficamente como
una línea ondulada, flotando en el quiste, o sobre la zona
más declive. Es un patrón ecográfico de lesión quística en
el interior del quiste.
Tipo III (colecciones multiseptadas o quistes multiloculares)
Se observa el quiste con múltiples cavidades de pare-
des nítidas en cuyo interior se pueden ver vesículas hijas.
Tiene un aspecto abigarrado por las distintas formas que
éstas pueden adoptar, lo que es signo de su desintegra-
ción (figuras 3 y 4).
Siempre presenta un aspecto multilocular o multive-
sicular. Pueden aparecer varios patrones ecográficos:
• En “panal de abejas”, si las vesículas crecen de forma
libre.
• En “roseta” o “rueda de carro”, si la disposición de las
vesículas es periférica.
• En algunos quistes la cavidad puede estar enteramen-
te ocupada por un contenido ondulante, serpentean-
te, formado por membranas al comprimirse unas ve-
sículas con otras.
A pesar de poder considerarse este estadio casi como
patognomónico, se ha de realizar también el diagnóstico
diferencial con otras lesiones ocupantes de espacio, bien
primarias o secundarias, tales como:
• El cistoadenoma hepático, que tiene tabiques y a ve-
ces papilas; sus imágenes son pseudovesículas, no tan
redondeadas.
• El cistoadenocarcinoma.
• La enfermedad poliquística hépatica: por lo general,
se suele asociar con presencia de quistes en el parén-
quima renal, dentro del contexto de la enfermedad
poliquística hepática autosómica dominante.
• Tumores que sufren necrosis interna, cuya licuefac-
ción semeja a un quiste complejo. El estudio completo
y el cuadro clínico ayudan a poder dilucidar la sospe-
cha diagnóstica.
Figuras 3 y 4.- Quistes hidatídicos Gharbi tipo III.
EEuurrooEEccoo
Rubio Torres C, Muñoz Ruiz MA, Fuster Palacio C, Carmona Calderón M, Permanyer Barrier J, Durán Rodríguez FJ. Hidatidosis hepática.
EuroEco 2012;3(1):1-5. 4
Tipo IV (masas heterogéneas complejas con aspecto predominantemente sólido)
En este estadio evolutivo el quiste tiene un aspecto
redondeado con contenido sólido y con formas variables.
Se observa una ocupación total de la cavidad quística
por la matriz hidatídica. El material sólido se va deposi-
tando en la zona más declive del quiste; por su aparien-
cia se denomina quiste con “arena hidatídica”; su aspecto
es más o menos blanquecino.
Se trata del más difícil de diferenciar por ecografía, ya
que puede aparecer isoecogénico con el hígado. Se le ha
denominado “imagen en nevada”. En él las membranas
germinativas son muy activas y dan lugar a múltiples ve-
sículas hijas (figuras 5 y 6).
Figuras 5 y 6.- Quistes hidatídicos Gharbi tipo IV.
En este tipo debemos considerar el diagnóstico dife-
rencial con el absceso hepático, con pared gruesa y con-
tenido sólido en el interior, en el que puede haber nivel
líquido o no. En todo caso, el contexto clínico es diferen-
te.
Tipo V (gruesas calcificaciones de la pared)
La pared se encuentra calcificada en mayor o menor
medida; también puede haber calcificación del contenido
(figura 7).
Figura 7.- Quiste hidatídico Gharbi tipo V.
Se puede considerar que un quiste está inactivo si su
pared está muy calcificada; sin embargo, la calcificación
parcial de la pared no indica inactividad del parásito.
Este tipo puede coexistir con otros quistes no calcifi-
cados.
El aspecto ecográfico es el de una formación con con-
torno ecogénico de forma convexa anterior, con impor-
tante sombra acústica posterior que, si la calcificación es
total y densa, no permite ver la pared posterior.
BIBLIOGRAFÍA
• Brunetti E, Kern P, Vuitton DA, and the Writing Panel for the
WHO-IWGE. Expert consensus for the diagnosis and treat-
ment of cystic and alveolar echinococcosis in humans. Acta
Tropica 2010;114:1-16.
• Chopdat N, Menezes CN, John MA, et al. A gardener who coug-
hed up blood. Lancet 2007;370:1520.
• Djuricic SM, Grebeldinger S, Kafka DI, Djan I, Vukadin M, Va-
siljevic ZV. Cystic echinococcosis in children - The seventeen-
year experience of two large medical centers in Serbia, Para-
sitology International 2010;59:257-61.
• Gavidia CM, Gonzalez AE, Zhang W, et al. Research. Diagnosis
of Cystic Echinococcosis, Central Peruvian Highlands. EID,
2008;14(2).
• Hemphill A, Spicher M, Stadelmann B, et al. Innovative che-
motherapeutical treatment options for alveolar and cystic
echinococcosis. Parasitology 2007;134:1657-70.
• Jenkins DJ, Romig T, Thompson RCA. Emergence/re-emer-
gence of Echinococcus spp.—a global update. Int J Parasitol
2005;35:1205-19.
• Kern P. Medical treatment of echinococcosis under the gui-
dance of Good Clinical Practice (GCP/ICH). Parasitol Int
2006;55(Sup 1):S273-S282.
• Lewall DB, McCorkell SJ. Rupture of echinococcal cysts: diag-
nosis, classification, and clinical implications. AJR 1986;146:
391-4.
• Mittelstaedt. Ecografía general. Madrid: Marban 2009.
• Moro P, Schantz PM. Echinococcosis: a review. International
Journal of Infectious Diseases 2009;13:125-33.
• Moscatelli G, Freilij H, Altcheh J. Hidatidosis (equinococosis
quística). En: Voyer L, Ruvinsky R, Cambiano C (eds). Pedia-
tría. 3ª edición. Buenos Aires: Editorial Journal 2008.
• Muñoz P. Comentario Editorial: Diagnóstico y tratamiento de
la hidatidosis. Rev Chil Infectol2007;24:153-4.
EEuurrooEEccoo
Rubio Torres C, Muñoz Ruiz MA, Fuster Palacio C, Carmona Calderón M, Permanyer Barrier J, Durán Rodríguez FJ. Hidatidosis hepática.
EuroEco 2012;3(1):1-5. 5
• Nakao M, Yanagida T, Okamoto M, Knapp J, Nkouawa A, Sako
Y, Ito A. State-of-the-art Echinococcus and Taenia: Phyloge-
netic taxonomy of human-pathogenic tapeworms and its ap-
plication to molecular diagnosis. Infection, Genetics and Evo-
lution 2010;10:444-52.
doi:10.1016/j.meegid.2010.01.011
• Rogan MT, Hai WY, Richardson R, Zeyhle E, Craig PS. Hydatid
cysts: does every picture tell a story? Trends Parasitol 2006;
22:431-8.
• Rumack CM, et. al. Diagnóstico por ecografía. Madrid: Mar-
ban 2006.
• Santolaya Sardinero F, Sáez Martínez FJ. Manual de Medicina
General y de Familia. Madrid: Medgen 2010; vol 2, 474-85.
• Schantz P. Progress in diagnosis, treatment and elimination
of echinococcosis and cysticercosis. Parasitol Int 2006;55(sup
1):S7-S13.
doi:10.1016/j.parint.2005.11.050
• Schneider R, Gollackner B, Edel B, Schmid K, Wrba F, Tucek G,
Walochnik J, Auer H. Development of a new PCR protocol for
the detection of species and genotypes (strains) of Echinococ-
cus in formalin-fixed, paraffin-embedded tissues. Int J Parasi-
tol 2008;38:1065-71.
doi:10.1016/j.ijpara.2007.11.008
• Villalobos N, González LM, Morales J, De Aluja AS, Jiménez MI,
Blanco MA, Harrison LJS, Gárate T. Molecular identification
of Echinococcus granulosus genotypes (G1 and G7) isolated
from pigs in Mexico. Veterinary Parasitology 2007;147:185-
9.
• WHO Informal Working Group. International classification of
ultrasound images in cystic echinococcosis for application in
clinical and field epidemiological settings. Acta Tropica 2003;
85:253-61.