ón vicariante en el género · PDF filemultiplicidad de los patrones observados,...
Transcript of ón vicariante en el género · PDF filemultiplicidad de los patrones observados,...
Interciencia
ISSN: 0378-1844
Asociación Interciencia
Venezuela
Bonilla Rivero, Ana; López Rojas, Héctor; Machado Allison, Antonio
Especiación vicariante en el género gephyrocharax eigenmann 1912 (pisces: characidae:
glandulocaudinae) de Venezuela
Interciencia, vol. 27, núm. 3, marzo, 2002, pp. 118-127
Asociación Interciencia
Caracas, Venezuela
Disponible en: http://www.redalyc.org/articulo.oa?id=33906604
Cómo citar el artículo
Número completo
Más información del artículo
Página de la revista en redalyc.org
Sistema de Información Científica
Red de Revistas Científicas de América Latina, el Caribe, España y Portugal
Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto
118 MAR 2002, VOL. 27 Nº 3
PALABRAS CLAVE / Especiación / Morfología Cuantitativa / Isoenzimas / Biogeografía / Pisces /
Recibido: 13/08/2001. Modificado: 28/01/2002. Aceptado: 31/01/2002
Ana Bonilla-Rivero. Licenciada en Biología, Universidad Central de Venezuela (UCV). Doctoren Biología Mención Ecología, UCV. Docente-Investigador, Laboratorio de Genética y Morfología Evolutiva de Peces, Institutode Zoología Tropical (IZT), Facultad de Ciencias, UCV. Dirección: Instituto de Zoología Tropical, Facultad de Ciencias, Univer-sidad Central de Venezuela. Apartado 47058 Los Chaguaramos, Caracas 1041-A. e-mail: [email protected]
Héctor López-Rojas. Licenciado en Biología, UCV. Ph.D., Duke University, EEUU. Docente-Investigador, Laboratorio de Genética y Morfología Evolutiva de Peces, Instituto de Zoología Tropical (IZT), Facultad deCiencias, UCV.
Antonio Machado-Allison. Licenciado en Biología, UCV. Ph.D., Duke University, EEUU. Do-cente-Investigador, Laboratorio de Biosistemática de Peces, Instituto de Zoología Tropical (IZT), Facultad de Ciencias, UCV.
ESPECIACIÓN VICARIANTE EN EL GÉNEROGephyrocharax Eigenmann 1912
(PISCES: CHARACIDAE: GLANDULOCAUDINAE)DE VENEZUELA
ANA BONILLA-RIVERO, HÉCTOR LÓPEZ-ROJASy ANTONIO MACHADO-ALLISON
0378-1844/02/03/118-10 $ 3.00/0
as polémicas actualesacerca del origen de lospatrones de diversidad
que se observan en la naturaleza requiere,más allá de la simple descripción de lamultiplicidad de los patrones observados,tratar de alcanzar un nuevo entendimientoacerca de las causas de la formación denuevas especies (especiación), para tratarde encontrar evidencias que expliquen losprocesos involucrados en la aparición yconservación de tales patrones. En estesentido se encuentran en la literatura dosperspectivas principales: la sistemáticadescriptiva, cuyo interés se centra en ladescripción de los diferentes patrones(morfológico, genético, etológico, embrio-lógico) observables actualmente en losgrupos de organismos que ocupan dife-rentes ambientes y el punto de vista evo-lutivo, que otorga mayor importancia alos procesos que han dado origen a talespatrones de diversidad.
La mayoría de los auto-res concuerdan en una secuencia ordena-da de eventos que definen la aparición denuevas especies, la cual, en una formaabreviada, puede describirse de la manerasiguiente: inicialmente un linaje parentalse divide con la concurrente aparición de
diferencias entre los linajes divergentes.Tales diferencias, que causan una reduc-ción (o eventual supresión) del flujo ge-nético entre los linajes, hacen que la se-paración de éstos se torne irreversible yeventualmente produzca una nueva identi-dad en cada linaje divergente.
La forma más aceptadade especiación ha sido el modelo alopá-trico propuesto por Mayr (1963), dondela aparición de una barrera que promuevala separación espacial de los linajes di-vergentes es esencial para el proceso dediferenciación y aparición de nuevas es-pecies. En el modelo alternativo de espe-ciación simpátrica, propuesto por Bush(1969, 1975), entre otros, los individuosde una población que se desplacen a unnuevo hábitat (o a un nuevo huésped enel caso de especies parásitas), como con-secuencia de una preferencia genética-mente establecida, pueden originar unanueva población genéticamente aislada,diferente de la población parental (End-ler, 1977). En esta propuesta, la separa-ción espacial de los nuevos linajes no esrequisito para la eventual diferenciación yaparición de nuevas especies.
Desde una perspectivamuy general, los análisis de patrones
morfológicos han estado tradicionalmentedirigidos a la asociación entre caracterespropios del fenotipo de individuos de po-blaciones locales, en respuesta a variablesambientales (Lauder, 1981). Tales compa-raciones morfométricas incluyen el méto-do de las cerchas (box truss) para lacomparación de hitos homólogos olandmarks (López-Rojas, 1982; Strauss yBookstein, 1982; Bookstein et al., 1985;Machado-Allison et al., 1990; Machado-Allison y Fink, 1991; 1996); la utiliza-ción de video-digitalización de imágenes(Machado-Allison y Fink, 1991; Chernoffy Machado-Allison, 1999); la incorpora-ción de aparatos como el diágrafo (Ló-pez-Rojas, 1992) y los análisis estadísti-cos como el de componentes principalesy la modificación propuesta por Hum-phries et al. (1981) para eliminar el efec-to del tamaño en el análisis de las for-mas. Los ponentes de un enfoque estric-tamente genético observan por el contra-rio que, a pesar de que se han reportadodiferencias selectivas entre genotipos paraloci que codifican diferentes proteínas, lamayoría de las diferencias encontradasson selectivamente neutras o a lo sumo,sujetas a fuerzas selectivas débiles. La di-ferenciación electroforética refleja, con
MAR 2002, VOL. 27 Nº 3 119
mayor probabilidad, tasas de migración yderiva génica, más que adaptaciones loca-les (Leary y Booke, 1990).
La imprecisión que sehalla en la literatura acerca de los factoresque determinan la aparición de nuevas es-pecies, es un reflejo de la dificultad parala determinación de las causas últimas delos patrones de diversidad que se observaen los diferentes ambientes. Ciertamente,la morfología determina en cierta medidael intervalo ecológico del fenotipo, pero almismo tiempo puede limitar la distribu-ción geográfica de las poblaciones, asícomo la coexistencia de poblaciones encomunidades locales (Ricklefs, 1987;1988). Otro aspecto importante muchasveces olvidado en algunos análisis, es elpapel que juegan características filogené-ticamente conservativas de los organismosy que sólo pueden ser evidenciadas me-diante análisis filogenéticos e históricosde grupos monofiléticos (Lundberg et al.,1986; Lauder y Liem, 1989). De esta ma-nera, la aparición de una novedad evoluti-va en una población local podría ser origi-nada por un factor ambiental y luego sermoldeado por un factor selectivo o neutro.
De una manera generalse postula que si los intervalos de distri-bución de los grupos considerados no ex-hiben superposición, se evidenciarían pro-cesos de especiación alopátrica, mientrasque superposiciones extensas apuntaríanhacia la presencia de simpatría o parapa-tría. Las condiciones que promueven unou otro tipo de especiación y el problemaasociado de asignar un valor de jerarquíaa cada uno de estos fenómenos en la ex-plicación de los patrones de diversidadobservados. Sin embargo, puede interpre-tarse en una forma más objetiva medianteel estudio de organismos cercanamenterelacionados, con una clara comprensiónde sus relaciones filogenéticas, su distri-bución geográfica y, más importante, lascircunstancias geológicas bajo las cualesse han producido tales patrones de diver-sidad en los lugares donde existen las es-pecies consideradas.
Con relación a los patro-nes de diversidad de los peces de aguascontinentales de Venezuela, se tiene pococonocimiento sobre su distribución geográ-fica, utilización de hábitats e hipótesis re-sueltas de relaciones filogéneticas. Recien-temente, en Venezuela se han iniciado es-tudios acerca de la distribución geográficade las especies de peces de agua dulceprincipalmente de la región sur del país(Chernoff et al., 1991; Lasso et al., 1991;Schaefer y Provenzano, 1993; Provenzanoet al., 1995; Lasso y Provenzano, 1997).
El género Gephyrocharaxrepresenta un ejemplo interesante para larealización de estudios de variación geográ-
fica y especiación, yaque las especies que loconforman se diferen-cian únicamente me-diante patrones de colo-ración de las aletas y enalgunas manchas corpo-rales (Schultz, 1944;Dahl, 1971) y presentanun patrón de distribu-ción geográfica muyparticular. Dentro delgénero se reconocen ac-tualmente 10 especies(Schultz, 1944), distri-buidas desde Costa Ricahasta Ecuador, sobre lapendiente pacífica de losAndes y en las cuencas de los ríos Orinocoy Amazonas (Weitzman y Burns, 1995). Enel patrón de distribución de las especiespresentes en Venezuela, G. valencia, G. ve-nezuelae y G. melanocheir, predomina lacondición alopátrica, excepto por dos loca-lidades en la región centro-occidental dondese encuentran G. valencia y G. venezuelaeen simpatría.
Con base en las premi-sas anteriores, se establece como objetivode este trabajo obtener información mor-fométrica y genética básica de las espe-cies representativas del género Gephyro-charax (G. valencia, G. venezuelae y G.melanocheir; Characidae: Glangulocaudi-nae) en Venezuela, para tratar de determi-nar el nivel de diferenciación morfológicay genética que pueda existir entre ellas y,con la ayuda de la evidencia geológicadisponible sobre la región, establecer unahipótesis biogeográfica que incorpore losposibles procesos evolutivos que han teni-do lugar durante la historia de este grupo.
Materiales y Métodos
Morfometría
Para los análisis morfo-métricos se procesaron 81 ejemplares, 31de ellos pertenecientes a G. valencia, 30a G. venezuelae y 20 a G. melanocheir.En este estudio se utilizaron ejemplarescolectados especialmente para este trabajocon chinchorros, así como material co-rrespondiente a la Colección de Peces delMuseo de Biología de la UniversidadCentral de Venezuela (MBUCV). Las lo-calidades estudiadas para cada una de lasespecies fueron: G. valencia: QuebradaMariara, Aragua (MBUCV-V-3029; 9ejemplares); Boca del río, Lago de Valen-cia (MBUCV-V-3023; 1 ejemplar); RíoSan Diego (MBUCV-V-3051; 1 ejemplar);Río Cúpira, Cuenca del Lago de Valencia(material no catalogado; 20 ejemplares).G. venezuelae: Río Alpargatón (material
no catalogado; 18 ejemplares); Río Urama,Cuenca del Caribe (material no cataloga-do; 12 ejemplares). G. melanocheir: RíoMeachiche, Cuenca del Caribe (materialno catalogado; 20 ejemplares).
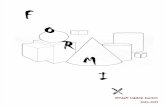
Una vez fijados enformol al 10% y preservados posterior-mente en alcohol al 70%, los ejemplaresse procesaron siguiendo el método de lascerchas (Strauss y Bookstein, 1982), queconsiste en la determinación de hitos opuntos homólogos en el entorno de laforma externa de los peces, tales que losmismos sean identificables y reproduci-bles en todos los ejemplares estudiados.Esta técnica proporciona informaciónacerca de las variaciones en la forma nosólo en el plano longitudinal, sino tam-bién en el vertical. Para las especies enestudio, la combinación de 11 puntos ho-mólogos dió como resultado 23 medidascorrespondientes al diseño de cerchasefectuado (Figura 1). El aporte de 10 me-didas convencionales (Tabla I; x8, x23-x34) condujo a un total de 33 medidasmorfométricas por cada ejemplar. Estasmedidas fueron realizadas con un VernierHelios de 0,05mm de apreciación.
El programa NewPC(versión 0.93) de Humphries y Swoffordse utilizó para el análisis de componentesprincipales cizallados (Sheared PrincipalComponent Analysis), con base en lasmedidas obtenidas mediante el método delas cerchas. Los valores de las distanciasinterpuntos homólogos se compararonempleando una matriz de covarianza delos logaritmos de los mismos. Para carac-terizar la covariación interpuntos homólo-gos, se graficaron las cargas de las mis-mas en el espacio definido por CP 1, CP2 y CP 3.
Electroforesis
Los ejemplares utilizadospara los análisis genéticos fueron captura-dos en el Río San Diego, Cuenca del
Figura 1. Esquema representativo de la aplicación del métodode las cerchas para Gephyrocharax, indicando la localizaciónde los hitos o puntos homólogos (1-11) sobre el contorno delpez. Se indican además el final del maxilar (12), el final delopérculo (13) y el diámetro del ojo (14).
120 MAR 2002, VOL. 27 Nº 3
Lago de Valencia (G. valencia), RíoAlpargatón, Cuenca del Caribe (G. vene-zuelae) y Río Meachiche, Cuenca del Ca-ribe (G. melanocheir), e inmediatamentecongelados completos en hielo seco paratransportarlos al laboratorio donde fueronpreservados a -80ºC hasta su procesamien-to. Siguiendo el método de electroforesisen gel de almidón en un sistema hori-zontal, se procesaron muestras de músculoesquelético de la región dorsal de 20ejemplares de cada una de las especies deGephyrocharax, según indicaciones deShaw y Prasad (1970) y Buth y Murphy(1990). Con los homogenados (Tris/EDTApH:7,0) se ensayaron 12 sistemas enzimá-ticos: lactato deshidrogenasa (LDH, EC.1.1.1.27), glucosa-6-fosfato isomerasa (GPI,E.C.5.3.1.9), fosfoglucomutasa (PGM, E.C.5.4.2.2), malato deshidrogenasa (MDH, EC.1.11.37), enzima málica (ME, E.C. 1.1.1.40), isocitrato deshidrogenasa (IDH, E.C.1.1.1.42), alcohol deshidrogenasa (ADH,E.C.1.1.1.1), glucosa deshidrogenasa (GDH,E.C.1.1.1.47), glucosa-6-fosfato deshidro-
genasa (G6PDH, E.C. 1.1.1.49), fosfoglu-conato deshidrogenasa (PGDH, E.C.1.1.1.44), esterasas generales (EST, E.C.3.1.1.)y superóxido dismutasa (SOD, E.C.1.15.1.1), además de proteínas generales (GP).La nomenclatura de los sistemas enzimáti-cos sigue las normas propuestas por Shak-lee et al. (1990) para estudios electroforé-ticos en peces. Para el revelado de estossistemas enzimáticos se siguieron las indi-caciones de Aebersold et al. (1987), Triest(1989) y Buth y Murphy (1990), con lige-ras modificaciones. Para la nomenclaturade los loci presuntivos observados sobrecada gel, así como sus alelos correspon-dientes, se siguieron las indicaciones deShaklee et al. (1990): los loci se enumera-ron en forma consecutiva comenzando porel número 1, desde el más catódico hastael más anódico; al alelo más común se leasignó el número 100 y al resto de losalelos el número correspondiente a la mo-vilidad relativa con respecto al alelo *100;los genotipos se identifican con las inicia-les de la enzima seguidas por un guión y
el número del locus y finalmente la com-posición alélica separada por una barra (p.ej. GPI-1*100/100), todo esto en letrasitálicas.
Una vez definidos losloci presuntivos se procedió a la identifica-ción de los genotipos individuales paracada locus en las tres poblaciones de lasespecies en estudio, siguiendo las sugeren-cias de Richardson et al., 1986; Leary yBooke, 1990 y May, 1992, para la inter-pretación de zimogramas. Con los resulta-dos obtenidos (genotipos individuales) secalcularon las frecuencias alélicas, la va-riabilidad genética intraespecífica medianteel porcentaje de polimorfismo (P) y hete-rocigosidad promedio (H), las desviacionesdel equilibrio Hardy-Weinberg de cadalocus para las poblaciones analizadas, lasimilaridad (I) y/o distancia genética (D)entre las tres especies, y la variabilidadgenética interespecífica (F
ST), con la utili-
zación del programa BIOSYS-1 versión1.7 (Swofford y Selander, 1989).
Resultados
Morfometría
Las diferencias en laforma corporal de los individuos de dife-rentes especies, o de poblaciones de lamisma especie, pueden ser analizadasmediante la comparación multivariada delas medidas (variables) interpuntos homó-logos en las cerchas construidas sobre elperfil de los individuos, utilizando com-ponentes principales. Adicionalmente, elcizallamiento de los componentes princi-pales tiene el efecto de remover el efectodel tamaño de los ejemplares, de maneraque se maximizan las diferencias deaquellas variables que contribuyen a laseparación de los grupos por su forma,independiente del tamaño.
Como resultado del aná-lisis de componentes principales de estasmedidas interpuntos, el primer componen-te es congruente con un componente detamaño; todos los coeficientes son positi-vos, con un intervalo muy parecido entreellos. Las cargas de los restantes compo-nentes examinados están representadaspor valores positivos y negativos, lo cualevidencia componentes de forma.
El análisis morfométricopara cada una de las especies determinóque existe un bajo nivel de dimorfismosexual en las poblaciones de G. valenciay G. venezuelae, en contraste con unaclara diferenciación entre los machos yhembras de G. melanocheir. Las variablesque contribuyen en mayor grado a las di-ferencias en esta última especie, estánasociadas principalmente a la región delmaxilar, a la distancia entre las aletas
TABLA IMEDIDAS MORFOMÉTRICAS OBTENIDAS MEDIANTE EL MÉTODO DE LAS
CERCHAS (X1-X23) SOBRE EJEMPLARES DEL GÉNERO Gephyrocharax*
VARIABLE INTERPUNTOS DISTANCIA
x1 1 - 10 Hocico-Supraoccipitalx2 1 - 9 Pre-pectoralx3 1 - 11 Hocico-Itsmox4 10 - 9 Supraoccipital-Origen aleta pectoralx5 10 - 11 Supraoccipital-Itsmox6 9 - 11 Itsmo-Origen aleta pectoralX7 10 - 2 Supraoccipital-Origen aleta dorsalX8 12 - 1 Largo del maxilarX9 10 - 8 Supraoccipital-Origen aleta pélvicaX10 2 - 8 Origen aleta dorsal-Origen aleta pélvicax11 2 - 9 Origen aleta dorsal-Origen aleta pélvicax12 8 - 9 Origen aleta pélvica-Origen aleta pectoralx13 2 - 3 Base de la aleta dorsalx14 2 - 7 Origen aleta dorsal-Origen aleta analx15 3 - 7 Final aleta dorsal-Origen aleta analx16 3 - 8 Final aleta dorsal-Origen aleta pélvicax17 7 - 8 Origen aleta anal-Origen aleta pélvicax18 3 - 4 Final aleta dorsal-Origen aleta adiposaX19 3 - 6 Final aleta dorsal-Final aleta analX20 4 - 6 Origen aleta adiposa-Final aleta analx21 4 - 7 Origen aleta adiposa-Origen aleta analx22 6 - 7 Base aleta analx23 4 - 5 Origen aleta adiposa-Complejo hipuralx24 5 - 6 Complejo hipural-Final aleta analx25 1 - 2 Pre-dorsalx26 1 - 7 Pre-analx27 1 - 5 Largo estándarx28 1 - 8 Pre-pélvicaX29 - Diámetro del ojoX30 - Ancho del cuerpo al nivel de la pectoralx31 - Ancho interorbitalx32 1 - 13 Largo de la cabezax33 1 - 12 Largo del hocico
*Medidas convencionales (x8, x25-x33), resaltadas.
MAR 2002, VOL. 27 Nº 3 121
Electroforesis
Sistemas enzimáticos yloci presuntivos. Once de los sistemasprotéicos ensayados, revelaron bandas losuficientemente bien definidas como paraestablecer los patrones iso y aloenzimáti-cos para dieciocho loci presuntivos; úni-camente los sistemas SOD y G6PDH nomostraron un revelado nítido como paraidentificar los loci presuntivos que losconforman. Las esterasas revelaron dosloci anódicos y heterócigos, con EST-1*bien definido para hígado y EST-2* paramúsculo (Figura 4A). Glucosa-6-fosfatoisomerasa (GPI) mostró dos loci, con GPI-A* heterócigo y GPI-B* monomórfico (Fi-gura 4B). Los sistemas isocitrato des-hidrogenasa (IDH) y enzima málica (ME)revelaron un único locus monomórfico cadauno de ellos (Figuras 5A y B, respectiva-mente), mientras que la fosfoglucomutasa(PGM) presentó un único locus heterócigo(Figura 5C). Estos cinco sistemas revelaronsiete loci presuntivos posiblemente diagnós-ticos para Gephyrocharax.
En los sistemas alcoholdeshidrogenasa (ADH), glucosa deshidro-genasa (GDH) y fosfogluconato deshidro-genasa (PGDH) se reveló un único locus
Figura 2. Morfoespacio definido por loscomponentes II y III para G. melanocheir.
Figura 3. Morfoespacio definido por loscomponentes II y IV para las tres especiesde Gephyrocharax.
TABLA IICARGAS DE LOS CUATRO PRIMEROS COMPONENTES PRINCIPALES
(2-4, CIZALLADOS) DE LAS VARIABLES ANALIZADAS (DISTANCIAS ENLAS CERCHAS) CORRESPONDIENTES A LAS TRES ESPECIES Gephyrocharax*
% Varianza por componente 83,2 5,7 2,6 1,3
Tamaño Forma
Variable CP 1 CP 2 CP 3 CP 4
Hocico-Supraoccipital 0,83 -0,217 0,154 0,008Pre-pectoral 0,170 0,086 -0,126 -0,041Hocico-Itsmo 0,140 0,481 -0,372 -0,041Supraoccipital-Origen aleta pectoral 0,155 -0,103 0,112 -0,016Supraoccipital-Itsmo 0,103 -0,161 0,107 -0,027Itsmo-Origen aleta pectoral 0,084 -0,325 0,125 -0,081Supraoccipital-Origen aleta dorsal 0,079 0,130 -0,036 -0,131Largo del maxilar 0,253 0,237 -0,024 0,067Supraoccipital-Origen aleta pélvica 0,233 0,152 0,276 0,302Origen aleta dorsal-Origen aleta pélvica 0,254 -0,010 -0,065 -0,013Origen aleta dorsal-Origen aleta pélvica 0,260 0,082 0,030 0,027Origen aleta pélvica-Origen aleta pectoral 0,167 0,244 0,434 0,151Base de la aleta dorsal 0,081 -0,059 0,033 -0,321Origen aleta dorsal-Origen aleta anal 0,217 -0,183 -0,009 0,058Final aleta dorsal-Origen aleta anal 0,205 -0,173 -0,078 -0,110Final aleta dorsal-Origen aleta pélvica 0,228 -0,039 -0,114 -0,343Origen aleta anal-Origen aleta pélvica 0,156 0,062 0,054 -0,321Final aleta dorsal-Origen aleta adiposa 0,108 -0,235 0,149 0,023Final aleta dorsal-Final aleta anal 0,150 -0,137 -0,045 -0,002Origen aleta adiposa-Final aleta anal 0,114 0,071 -0,235 -0,107Origen aleta adiposa-Origen aleta anal 0,208 -0,217 -0,156 -0,143Base aleta anal 0,196 -0,079 -0,268 -0,077Origen aleta adiposa-Complejo hipural 0,073 -0,102 -0,360 0,474Complejo hipural-Final aleta anal 0,055 -0,270 -0,208 0,400Pre-dorsal 0,249 0,100 0,001 0,070Pre-anal 0,265 0,169 0,204 -0,044Largo estándar 0,258 -0,043 -0,091 0,155Pre-pélvica 0,242 0,165 0,189 0,192Diámetro del ojo 0,038 -0,018 0,052 -0,086Ancho del cuerpo al nivel de la pectoral 0,129 0,115 -0,170 0,068Ancho interorbital 0,070 -0,051 -0,019 0,057Largo de la cabeza 0,152 0,166 -0,120 -0,077Largo del hocico 0,074 0,071 -0,104 0,032
*Se resaltan las variables que más contribuyen con la variabilidad por cada componente.
pectoral y pélvica y a la longitud del pe-dúnculo caudal (Figura 2).
El análisis interespecífi-co mostró que los cuatro primeros com-ponentes explicaron el 92.8% de la va-rianza total en la muestra estudiada (Ta-bla II). G. valencia y G. venezuelae, pre-sentaron formas corporales muy pareci-das, mientras que G. melanocheir mostróuna forma considerablemente distinta alas otras dos.
El espacio morfológicodefinido por los componentes II y IV (Fi-gura 3), contrasta a G. melanocheir en laextrema derecha de la figura con G. ve-nezuelae y G. valencia en la región iz-quierda de la misma. Los ejemplares de
G. melanocheir presentaron un mayor de-sarrollo del hocico, la aleta pectoral enuna posición más anterior y el pedúnculocaudal proporcionalmente más desarrolla-do que las otras dos especies.
La combinación de loscomponentes II y IV, y en menor medidadel componente III (no representado en laFigura, ver Tabla II), separa a G. va-lencia de G. venezuelae, contrastando va-riables de la región de la cabeza y partemedia del cuerpo, en adición al desarro-llo del pedúnculo caudal. Es importanteresaltar que existe una zona de superposi-ción de algunos individuos de ambas es-pecies, lo cual denota las formas corpora-les más parecidas entre ellas.
122 MAR 2002, VOL. 27 Nº 3
presuntivo para cada uno de ellos. En elcaso de las proteínas generales (GP) serevelaron dos loci; la enzima lactato des-hidrogenasa (LDH) mostró dos loci biendefinidos, con una mayor actividad dellocus LDH-A*, mientras que la malatodeshidrogenasa (MDH) presentó cuatroloci con mayor actividad para el locusMDH-1*. Todos los loci presuntivos antesmencionados resultaron ser anódicos,monomórficos e iguales para las tres po-blaciones de las especies de Gephyrocha-rax.
Para algunos sistemas,como por ejemplo las esterasas generales(EST), quedó de manifiesto que existeuna expresión diferencial de las isoenzi-mas que los conforman según el tipo detejido del cual proviene. Así, el locusEST-1* se revela mejor en hígado, mien-tras que EST-2* tiene su mayor actividaden la musculatura blanca; esta condiciónse presentó por igual para las tres espe-cies de Gephyrocharax.
Frecuencias alélicas yvariabilidad genética. En la Tabla III sedetallan las frecuencias alélicas para losloci polimórficos revelados para las po-blaciones estudiadas de Gephyrocharax(EST-1*, EST-2*, GPI-A*, GPI-B*, IDH*,ME* y PGM*), así como para los locicon alelos fijados. El cálculo del porcen-taje de loci polimórficos (<0,990) reveló
a las especies G. venezuelae y G. mela-nocheir con tres loci polimórficos cadauna, coincidiendo en dos de ellos: EST-1*y PGM*. Igualmente, EST-1* es el únicolocus polimórfico para la especie G.valencia, de manera que este locus puedeconsiderarse como el que contiene la ma-yor cantidad de variación para el grupoen estudio. Los mayores valores de h co-rrespondieron a los loci GPI-A* en G.venezuelae, EST-1* en G. valencia y G.venezuelae y EST-2* en G. melanocheir.Los restantes 14 loci revelados (ADH*,GDH*, GP-1*, GP-2*, GPI-B*, IDH*,LDH-A*, LDH-B*, MDH-1*, MDH-2*,MDH-3*, MDH-4*, ME* y PGDH*) sepresentan como monomórficos, pero enalgunos casos con movilidades alélicasdiferentes (GPI-B*, IDH* y ME*). Estostres últimos loci, pueden representar locidiagnósticos entre las especies de Ge-phyrocharax, por las diferencias en movi-lidad que presentan sus alelos fijados.
Un resumen de los cál-culos de H y P para las tres especies deGephyrocharax se presentan en la TablaIV. Los resultados indican que ambos va-lores para G. valencia son mucho meno-res que para G. venezuelae y G. melano-cheir. Estas dos últimas especies poseenun nivel de polimorfismo exactamenteigual y heterocigosidad promedio muy se-mejante, pero de origen diferente; de los
tres loci variables de G. venezuelae, dosde ellos (EST-1* y GPI-A*) presentan va-lores muy cercanos a las frecuencias delos alelos que conforman cada locus, locual se traduce en altos valores de h y elotro locus (PGM*) presenta una frecuen-cia de 0,900 para el alelo más común,que significa un valor muy bajo de h. Encuanto a G. melanocheir, los tres loci va-riables (EST-1*, EST-2* y PGM*) mues-tran valores de frecuencias alélicas másequilibrados, lo que proporciona un valormoderado de h. Cuando se calcula Hpara cada especie, los valores se compen-san y generan una heterocigosidad pro-medio muy similar.
El sistema enzimático delas esterasas generales se conoce por sualta variabilidad en peces (Koehn, 1969;Koehn et al., 1971; Avise y Selander,1972; Kornfield y Koehn, 1975; McKay yMiller, 1991) y están consideradas comoisoenzimas poco específicas que utilizansubstratos originados en el ambiente ex-terno; este tipo de enzimas se consideranmás variables que las que usan metaboli-tos internos específicos como substratos(Johnson, 1973). El polimorfismo detecta-do en GPI también contribuye en gradosignificativo a la diferenciación entre lasespecies de Gephyrocharax, ya que ésta,como el resto de las isoenzimas que re-gulan el metabolismo de la glucosa, son
Figura 4. Esquemas de los electromorfos observados para los siste-mas (A) EST y (B) GPI, en las tres especies de Gephyrocharax es-tudiadas. Se indican los genotipos y su frecuencia observada.
Figura 5. Esquemas de los electromorfos observados para los sistemas(A) IDH, (B) ME y (C) PGM, en las tres especies de Gephyrocharaxestudiadas. Se indican los genotipos y su frecuencia observada.
MAR 2002, VOL. 27 Nº 3 123
sistemas fundamentales para el funciona-miento global de cada individuo. Johnson(1973) señala que “se espera que loscambios en loci cuyas enzimas regulan elflujo metabólico, produzcan alteracionesen la aptitud (fitness) mucho mayoresque aquellos que afectan a las enzimasque no regulan ninguna vía metabólica”.Los estudios del sistema GPI en pecesóseos proveen fuerte evidencia a favor deun modelo de control genético por dosloci estructurales independientes, comoresultado de una duplicación génica muycercana a los orígenes de los teleósteos(Avise y Kitto, 1973). Inclusive, estos au-tores demostraron la condición ortóloga(homología en sistemática molecular)para los dos loci del sistema GPI (A yB). Cabe señalar que, además de la glu-cosa-6-fosfato deshidrogenasa, la condi-ción de ortología ha sido demostrada sólopara tres sistemas más: creatina kinasa(CK; A, B, C y D), lactato deshidrogena-sa (LDH; A y B) y malato deshidrogena-sa (MDH; A y B citosólicas); el uso deletras mayúsculas para la identificaciónde los loci en los sistemas ortólogos per-mite su diferenciación de los parálogos,en los que la homología no ha sido de-mostrada (Shaklee et al., 1990).
Por otra parte, medianteel análisis de chi-cuadrado (X2), con baseen los genotipos individuales, las frecuen-cias alélicas y las frecuencias genotípicas,se determinó la desviación del equilibrioHardy-Weinberg para cada uno de losloci polimórficos encontrados. Únicamen-te los loci PGM* correspondientes a G.venezuelae y G. melanocheir se encuen-tran en equilibrio puesto que los valorescalculados de X2 son menores que el va-lor teórico (tabla de X2, con 95% de con-fianza y un grado de libertad). Los lociEST-1*, EST-2* y GPI-A* presentan unadesviación del equilibrio (X2 es mayorque el valor teórico), sugiriendo que, unoo varios procesos (selección, mutación,deriva génica al azar, migración) puedenestar afectando las frecuencias génicas ygenotípicas de las poblaciones estudiadas.Complementando la información anterior,se determinó que todos los loci polimórfi-cos mostraron una deficiencia de hetero-cigotos para las poblaciones analizadas,salvo el locus PGM* de G. venezuelae.
Coeficientes de similari-dad y distancias genéticas. El estadísticoF
ST, representa la medida estándar de di-
vergencia en loci individuales entre po-blaciones (Allendorf y Phelps, 1981); enestos datos se observa que el coeficienteF
ST promedio es relativamente elevado
(0,696), con EST-2*, GPI-A*, GPI-B*,IDH* y ME* como los loci que mayor-mente contribuyen con la diferenciaciónentre las poblaciones de Gephyrocharax.
Es importante resaltar que los dos prime-ros son loci polimórficos y su contribu-ción a la variabilidad interespecífica esapreciable, pero los restantes son locimonomórficos fijados para cada una de
las especies de Gephyrocharax, con unaporte máximo (1.000). Los datos elec-troforéticos convertidos en estimadosfenéticos de diferenciación genéticamuestran que G. venezuelae y G. melano-
TABLA IIIFRECUENCIAS ALÉLICAS Y HETEROCIGOSIDAD POR LOCUS
(H; ESTIMACIÓN NO-SESGADA SEGÚN NEI, 1978) PARA LOS LOCIPOLIMÓRFICOS Y FIJADOS EN LAS POBLACIONES DEG. valencia, G. venezuelae y G. melanocheir ESTUDIADAS
Locus y número de individuos
EST-1* EST-2* GPI-A* GPI-B* IDH* ME* PGM*10 20 10 20 20 20 20
Locus G. valencia
*98 0,450 1,000 0,000 1,000 0,000 1,000 0,000*100 0,550 0,000 1,000 0,000 1,000 0,000 1,000h 0,521 0,000 0,000 0,000 0,000 0,000 0,000
G, venezuelae
*98 0,550 0,000 0,000 0,000 0,000 0,000 0,100*100 0,450 1,000 0,400 1,000 1,000 1,000 0,900*105 0,000 0,000 0,550 0,000 0,000 0,000 0,000*110 0,000 0,000 0,050 0,000 0,000 0,000 0,000h 0,521 0,000 0,563 0,000 0,000 0,000 0,185
G, melanocheir
*98 0,000 0,150 0,000 0,000 1,000 0,000 0,225*100 0,750 0,600 0,000 1,000 0,000 1,000 0,775*102 0,000 0,250 0,000 0,000 0,000 0,000 0,000*105 0,250 0,000 0,000 0,000 0,000 0,000 0,000*110 0,000 0,000 0,000 0,000 0,000 0,000 0,000*-100 0,000 0,000 1,000 0,000 0,000 0,000 0,000h 0,395 0,569 0,000 0,000 0,000 0,000 0,358
TABLA IVVARIABILIDAD GENÉTICA EN LOS 18 LOCI ANALIZADOS PARA
LAS POBLACIONES DEG. valencia, G. venezuelae y G. melanocheir
Heterocigosidadpromedio (H)
Tamaño Número Porcentaje Contaje Esperadapromedio promedio de loci directo según
de la muestra de alelos polimórficos* Hardy-Weinbergpor locus por locus (P) **
Especie
G. valencia 18,9 (1,0) 1,1 (0,1) 5,6 0,006 (0,006) 0,029 (0,029)
G. venezuelae 18,9 (1,0) 1,2 (0,1) 16,7 0,022 (0,013) 0,070 (0,042)
G. melanocheir 18,9 (1,0) 1,2 (0,1) 16,7 0,036 (0,021) 0,073 (0,041)
Entre paréntesis: error estándar.* Un locus se considera polimórfico si la frecuencia del alelo más común (*100) es menor de 0,950** Estimación no-sesgada según Nei, 1978.
124 MAR 2002, VOL. 27 Nº 3
muestra, inclusive, diferencias en la for-ma corporal de machos y hembras adul-tos. Lande (1980) señala que un fenotipodado será el resultado de fuerzas preser-vadoras y mecanismos que promueven lasvariaciones, proponiendo que la heterosis,la homeostasis genética y el flujo génicoactúan como las principales fuerzas quetienden a preservar la uniformidad fenotí-pica. Estas fuerzas se contraponen con elefecto fundador, la deriva genética y lasmutaciones. Así mismo, este autor discuteque el flujo génico y la homeostasis ge-nética confieren cohesión a una poblacióncentral grande, pero que en pequeñas po-blaciones periféricas aisladas, el mecanis-mo conocido como efecto fundador redu-ciría drásticamente la variabilidad genéti-ca, lo cual podría favorecer o inducir loscambios morfológicos. Este probablemen-te sea el mecanismo modelador de un pa-trón morfológico distinto en G. melano-cheir, cuyas poblaciones, a diferencia delas otras dos especies que tienen pobla-ciones simpátricas, presentan un marcadoaislamiento geográfico.
Los patrones genéticosindican una diferenciación entre las tresespecies estudiadas, según el estadísticoF
ST. Si se detallan los resultados obteni-
dos en cuanto a la similaridad genéticasegún Nei (1972), se observa que las es-pecies genéticamente menos parecidas,G. valencia y G. melanocheir, presentanun valor de identidad alto (I = 0,721), esdecir, que comparten el 72,1% de losalelos analizados. Por su parte G. vene-zuelae y G. melanocheir comparten el87,5% de los alelos, y G. valencia y G.venezuelae tienen un 80,5% de alelos encomún. El análisis de las frecuenciasalélicas de los loci polimórficos y de losmonomórficos fijados, indica que: 1) G.melanocheir posee un alelo para EST-1*(*105) que no aparece en G. valencia niG. venezuelae; 2) aunque las tres espe-cies poseen frecuencias diferentes delalelo más común (*100) en el locusPGM*, G. valencia y G. venezuelaemuestran los valores de frecuencia másparecidos; 3) Para GPI-A*, el únicoalelo existente en G. melanocheir (*-100), no está presente en G. valencia niG. venezuelae; 4) El locus IDH* de G.venezuelae y G. valencia presenta unalelo *100 fijado, mientras que el alelofijado para G. melanocheir es el *98; y5) Para los loci ME y GPI-B*, G. vene-zuelae y G. melanocheir muestran unúnico alelo (*100), mientras que G.valencia presenta un alelo *98 fijado. Es-tos resultados indican que G. melanocheiry G. valencia se diferencian claramenteuna de la otra, mientras que G. venezue-lae presenta elementos génicos en comúncon las dos especies anteriores.
Figura 6. Análisis de agrupamiento utilizando el algoritmo UPGMA para determinar dis-tancia genética, D, según Nei (1978) para las tres especies de Gephyrocharax estudiadas.
Figura 7. Mapa de distribución de las tres especies del género Gephyrocharax de Venezue-la. Se incluyen las localidades donde se colectó en este trabajo, así como datos de las co-lecciones de peces del Museo de Biología de la UCV, Universidad del Zulia y UNELLEZ,y de las referencias bibliográficas citadas en el texto. 1: G. valencia; 2: G. venezuelae; y3: G. melanocheir.
cheir son genéticamente muy cercanas ydistanciadas de G. valencia. Estos resul-tados se representan en forma más claraen el fenograma de la Figura 6, realizadomediante un análisis de agrupamiento se-gún algoritmo de UPGMA con los indi-cadores de Nei (1972; 1978).
Discusión
El estudio de los patro-nes morfológicos, genéticos y de distribu-ción geográfica y su relación con los pro-cesos que los originan, es una tarea difí-cil. Sin embargo, el enfoque integral deestos elementos dentro de grupos monofi-léticos, provee información más precisaque permite generar hipótesis acerca deestas complejas relaciones. Un buen
ejemplo para aplicar este tipo de enfoquemultifactorial son las especies del géneroGephyrocharax de Venezuela, en donde lacaracterización morfológica basada ensimples patrones de coloración muy parti-culares, la carencia de información gené-tica sobre el grupo y un patrón de distri-bución geográfica predominantementealopátrico, conforman un caso interesantepara tratar de explicar las posibles causasque originaron la distribución actual delas especies del género.
El análisis de los datosmorfométricos revela que cada una de lasespecies presenta patrones morfológicosparticulares, según los cuales las especiesG. valencia y G. venezuelae presentanmayor similitud en la forma corporal, conrelación a G. melanocheir. Esta última
MAR 2002, VOL. 27 Nº 3 125
Las tres especies del gé-nero muestran patrones de distribución muyinteresantes según se observa en la Figura7. La especie G. melanocheir presenta unpatrón disyunto muy particular, con repre-sentantes en la cuenca del río Magdalenade Colombia (Schultz, 1944; Dahl, 1971),en el noreste de la cuenca del Lago de Ma-racaibo en el Zulia (Taphorn y Lilyestrom,1984) y en la Sierra de San Luis en Falcón(colecciones en este trabajo), para Venezue-la. Por su parte, G. venezuelae se distribuyeprincipalmente en el suroeste y sureste dela cuenca del Lago de Maracaibo (Schultz,1944; Galvis et al., 1997), aunque tambiénha sido reportada para la región oriental delEstado Falcón (Cueva del Indio, Cerro deChichiriviche; López-Rojas et al., 1996) yen algunos ríos de la Vertiente del Caribepertenecientes a Carabobo y Falcón (Boni-lla y López-Rojas, 1997). Al igual que enel caso anterior, esta distribución correspon-de a un patrón disyunto de variación geo-gráfica (sensu Endler, 1977), en el cual unao más poblaciones están aisladas geográfi-camente del resto del taxón. La especie res-tante, G. valencia, presenta una amplia dis-tribución (Eigenmann, 1920; Schultz, 1944;Mago-Leccia, 1970; Taphorn, 1992) siendomuy común en las cuencas de los ríos Ori-noco, Cuyuní, los de la vertiente del Caribey los de la cuenca del Lago de Valencia, locual implica un patrón de distribución geo-gráfico mucho más continuo que los de lasdos especies anteriores. Un punto a resaltaren estas distribuciones es la condición dealopatría predominante que presentan estastres especies, según se desprende de losmuestreos realizados en el presente estudio,ya que solamente en el Río Alpargatón enla cuenca del Río Urama (vertiente del Ca-ribe) se han encontrado en simpatría las es-pecies G. venezuelae y G. valencia.
La distribución geográfi-ca actual de las especies de Gephyrocha-rax estudiadas, es consistente con una su-cesión de eventos vicariantes asociadoscon el movimiento de la desembocaduradel Río Orinoco desde el noroeste delpaís (actual Lago de Maracaibo) haceaproximadamente 38 millones de años(Eoceno) hacia el este en su localizaciónactual (Rod, 1981; Díaz de Gamero,1996), seguido por el levantamiento de laCordillera de Los Andes venezolanos. Elmovimiento oeste-este del sistema delOrinoco, paralelamente con el Amazonas,se asocia en el tiempo con una diversifi-cación faunística en toda la región(Lundberg et al., 1998).
Los eventos vicariantesantes mencionados posiblemente causaronel fraccionamiento de la población ances-tral que originaron las especies que hoyen día conforman el género Gephyrocha-rax. Se plantea entonces que la población
ancestral se encontraba ampliamente dis-tribuida en el proto-Orinoco (o proto-Magdalena) y debido al levantamiento dela Cordillera Oriental de Colombia y elsur de los andes merideños al final delMioceno medio (16,2-11 m.a.), se produ-jo el aislamiento de sub-poblaciones endiferentes localidades del centro y norestede Colombia y noroeste de Venezuela(actual G. melanocheir). Seguidamente, eldesplazamiento del proto-Orinoco haciael este, desde lo que hoy en día es elLago de Maracaibo, hacia el este del Es-tado Falcón, durante el Mioceno tardío(11-5 m.a.), dejaría subpoblaciones rema-nentes en toda la región del sur del Lagode Maracaibo y en la brecha entre la sie-rra falconiana y la Cordillera de la Costa(actual G. venezuelae), conocida tambiéncomo la depresión de Chivacoa. Final-mente, al tomar el Orinoco su curso ac-tual (hace aproximadamente 5 m.a.), enel canal principal se mantuvo la mayoríade la población ancestral, la cual se ex-tendió por gran parte del territorio nacio-nal (actual G. valencia).
Esta hipótesis biogeográ-fica, que incorpora elementos morfológi-cos, genéticos y geográficos, concuerdacon los lineamientos del modelo de espe-ciación alopátrica por efecto fundadorpropuesto por Bush (1975), en el cual laspoblaciones están usualmente adaptadas acierto nivel de endogamia y a selecciónpor homocigosidad. En las poblacionesestudiadas, estas características se reflejanen la deficiencia de heterocigotos (D) yen el elevado índice de fijación (F) obser-vados para las especies G. melanocheir yG. venezuelae. La deficiencia de heteroci-gotos en G. valencia también es elevadaen el único locus heterócigo revelado.Este último resultado no es absolutamenteconcordante con el modelo de Bush, yaque se esperaría que en poblaciones gran-des ampliamente distribuidas, el nivel deheterocigosidad promedio sea elevado. Eneste sentido, es importante resaltar que lapoblación de G. valencia estudiada perte-nece a los ríos de la cuenca del Lago deValencia, que tiene la peculiaridad de serde tipo endorréica, lo cual puede confe-rirle características genéticas similares ala de poblaciones pequeñas aisladas pro-puestas en el modelo de especiaciónalopátrica vicariante.
La relación entre varia-ción genética y su expresión morfológicaes muy compleja y representa actualmen-te un punto controversial, debido a la va-riedad de patrones que se obtienen al rea-lizar estudios que combinen aspectos delfenotipo y el genotipo. Es muy comúnencontrar en la literatura ejemplos en losque determinadas especies o grupos deellas presentan una alta variabilidad mor-
fológica, pero que resultan ser genética-mente indistinguibles; los casos contrariostambién han sido ampliamente reportados(Turner, 1974; Mickevich y Johnson,1976; Gorman y Kim, 1977; Nixon yTaylor, 1977; Larson et al., 1981; Shak-lee y Tamaru, 1981; Stepien y Rosenblatt,1991; Strauss, 1991; Kartavtsev, 1992).La información anterior sugiere que losloci que codifican para las proteínas me-tabólicas evolucionan a tasas diferentesde aquellos que determinan las caracterís-ticas morfológicas (Allendorf y Utter,1979), lo cual destaca la necesidad decombinar análisis genéticos y morfológi-cos en estudios de especiación.
En el caso que nos ocu-pa, una idea más clara acerca de la vali-dez del componente genético o morfoló-gico en la explicación de los patronesbiogeográficos observados, necesitará dela ampliación de este estudio a poblacio-nes de otras cuencas, posiblemente másrepresentativas como sería el caso de G.valencia para la cuenca del Orinoco, y unanálisis más detallado de las especies quese encuentran en simpatría.
Conclusiones
Los análisis morfométri-cos intraespecíficos mostraron que única-mente existe segregación morfológicacompleta entre machos y hembras de G.melanocheir. El análisis interespecíficoreveló una mayor similitud entre G.valencia y G. venezuelae, que ambas conrespecto a G. melanocheir. Las variablesque mayormente contribuyen con la va-riabilidad de la forma corporal detectadaentre las tres especies de Gephyrocharax,correspondieron a las distancias hocico -istmo e istmo- origen aleta pectoral y alas distancias asociadas con la longituddel pedúnculo caudal.
En el aspecto genético,para estas poblaciones se identificaron 11loci monomórficos e idénticos para lastres especies, 4 polimórficos y 3 loci fija-dos para diferentes alelos. G. venezuelaey G. melanocheir resultaron ser más va-riables que G. valencia, presentando estaúltima el menor valor de heterocigosidadpromedio (H), con un solo locus polimór-fico, contra tres loci en las otras dos es-pecies. Este nivel de variabilidad estácondicionado principalmente por el poli-morfismo detectado en los loci EST-1*,EST-2* y GPI-A* y en los alelos diferen-cialmente fijados para los loci GPI-B*,IDH* y ME*; el locus PGM*, aunquepolimórfico, contribuye en baja medida ala variabilidad observada. Los patronesgenéticos indican una diferenciación entrelas tres especies estudiadas, según el esta-dístico F
ST. A este respecto, G. melano-
126 MAR 2002, VOL. 27 Nº 3
cheir y G. valencia se diferencian clara-mente una de la otra, mientras que G. ve-nezuelae presenta elementos génicos encomún con las dos especies anteriores.
Los patrones genéticos ymorfológicos y la distribución de las es-pecies de Gephyrocharax, son consisten-tes con una sucesión de eventos vicarian-tes que pudieron haber causado el aisla-miento de pequeños grupos poblacionalesal oeste de Venezuela (G. venezuelae yG. melanocheir actuales). La mayor partede la población ancestral permaneció enel curso principal del Orinoco, extendién-dose por gran parte del territorio nacional(G. valencia actual). Estos eventos pue-den asociarse con el movimiento de ladesembocadura del Río Orinoco desde elnoroeste del país hacia el este hace 38-5millones de años, seguido por el levanta-miento de la Cordillera de Los Andeshace aproximadamente 11 millones deaños.
Una idea más clara acer-ca de la hipótesis biogeográfica planteadarequerirá de la ampliación de este estudioa poblaciones de otras cuencas.
AGRADECIMIENTOS
Este estudio fue cofinan-ciado por los proyectos CONICIT S1-95000515, 03-31-3451-95 (I Etapa) yCDCH 03-31-3451-99 (II Etapa).
REFERENCIAS
Aebersold PB, Winans GA, Teel DJ, Milner GB,Utter FM (1987) Manual for starch gel elec-trophoresis: A method for the detection ofgenetic variation. NOAA Technical ReportNMFS No. 61. 19 pp.
Allendorf FW, Utter F (1979) Population genet-ics. En Hoar WS, Randall DJ, Brett JR(Eds) Fish Physiology, vol. VIII. AcademicPress. pp. 407-454.
Allendorf FW, Phelps SR (1981) Use of allelicfrequencies to describe population structure.Can. J. Fish. Aquat. Sci. 38: 1507-1514.
Avise JC, Kitto GB (1973) PhosphoglucoseIsomerase gene duplication in bony fishes:An evolutionary history. Biochemical Gene-tics 8: 113-132.
Avise JC, Selander RK (1972) Evolutionary ge-netics of cave-dwelling fishes of the genusAstyanax. Evolution 26: 1-19.
Bonilla A, López-Rojas H (1997) Sexual dimor-phism in Gephyrocharax venezuelae (Charac-idae: Glandulocaudinae) in Venezuela. ActaBiol. Venez. 17: 45-49.
Bookstein F, Chernoff B, Elder R, Humphries J,Smith G, Strauss R (1985) Morphometrics inevolutionary biology. Special Publication 15.The Academy of Natural Science of Phila-delphia. 277 pp.
Bush GL (1969) Sympatric host race formationand speciation in frugivorous flies of the ge-nus Rhagoletis. Evolution 23: 237-251.
Bush GL (1975) Modes of animal speciation.Ann. Rev. Ecol. Syst. 6: 339-364.
Buth DG, Murphy RW (1990) Enzyme stainingformulas. En Hillis DM, Moritz C (Eds) Mo-lecular Systematics. Sinauer Associates. pp.99-126.
Chernoff B, Machado-Allison A (1999) Bry-conops colaroja and B. colanegra two newspecies (Teleostei, Characidae) from theCuyuni and Caroni drainages of SouthAmerica. Ichth. Explor. Freshwaters 10: 355-370.
Chernoff B, Machado-Allison A, Soul W (1991)Redescription and biogeography of Lepori-nus brunneus Myers. Ichth. Explor. Freshwa-ters 1: 295-306.
Dahl G (1971) Los peces del norte de Colombia.Ministerio de Agricultura, Inderena. 391 pp.
Díaz de Gamero ML (1996) The changing courseof the Orinoco river during the Neogene: areview. PALAEO 123: 385-402.
Eigenmann CH (1920) The fishes of LakeValencia, Caracas and the Rio Tuy at ElConcejo, Venezuela. Indiana University Stud-ies Vol. VII, No. 44. pp. 1-13.
Endler JA (1977) Geographic variation, specia-tion, and clines. Monographs in PopulationBiology No. 10. Princeton University Press.246 pp.
Fink W, Machado-Allison A (1992) Three newspecies of piranhas from Brazil and Vene-zuela. Ichth. Explor. Freshwaters 2: 57-75.
Fink W, Machado-Allison A (2001) A new spe-cies of piranha from Brazil, with commentson Serrasalmus altuvei and Serrasalmuscompressus (Teleostei:Characiformes). Ocass.Papers Museum of Zoology. Univ. Michigan730: 1-18.
Galvis G, Mojica JI, Camargo M (1997) Lospeces del Catatumbo. Asociación CravoNorte, Colombia. 118 pp.
Gorman GC, Kim YJ (1977) Genotypic evolutionin the face of phenotypic conservativeness:Abudefduf (Pomacentridae) from the Atlanticand Pacific sides of Panamá. Copeia 1977:694-697.
Humphries JM, Bookstein FL, Chernoff B, SmithGR, Elder RL, Poss SG (1981) Multivariatediscrimination by shape in relation to size.Syst. Zool. 30: 291-308.
Johnson GB (1973) Enzyme polymorphism andbiosystematics: the hypothesis of selectiveneutrality. Ann. Rev. Ecol. Sys. 4: 93-116.
Kartavtsev YP (1992) Allozyme heterozygosityand morphological homeostasis in pinksalmon, Onchorhynchus gorbucha (Wal-baum): evidences from family analysis. J.Fish Biol. 40: 17-24.
Koehn RK (1969) Esterase heterogeneity: Dy-namics of a polymorphism. Science 163:943-944.
Koehn RK, Pérez JE, Merritt RB (1971) Esteraseenzyme function and genetical structure ofpopulations of the freshwater fish Notropisstramineus. American Naturalist 105: 51-69.
Kornfield IL, Koehn RK (1975) Genetic variationand speciation in New World cichlids. Evo-lution 29: 427-437.
Lande R (1980) Genetic variation and the pheno-typic evolution during allopatric speciation.American Naturalist 116: 463-479.
Larson A, Wake DB, Maxson LR, Highton R(1981) A molecular phylogenetic perspectiveon the origins of morphological novelties in
the salamanders of the tribe Plethodontini(Amphibia, Plethodontidae). Evolution 35:405-422.
Lasso C, Provenzano F (1997) Chaetostoma vas-quezi, nueva especie de corroncho del Escu-do de Guayana, Estado Bolívar, Venezuela(Siluroidei:Loricariidae): descripción y consi-deraciones biogeográficas. Mem. Soc. Cienc.Nat. La Salle LVII: 53-65.
Lasso C, Machado-Allison A, Pérez R (1991)Consideraciones zoogeográficas de los pecesde la Gran Sabana (Alto Caroní) Venezuela,y sus relaciones con las cuencas vecinas.Mem. Soc. Cienc. Nat. La Salle IL y L: 109-127.
Lauder GV (1981) Form and Function: Structuralanalysis in evolutionary morphology. Paleo-biology 7: 430-442
Lauder GV, Liem KF (1989) The role of histori-cal factors in the evolution of complexorganismal functions. En Wake DB, Roth G(Eds) Complex Organismal Functions: Inte-gration and Evolution in Vertebrates. JohnWiley and Sons. pp. 63-78.
Leary RF, Booke HE (1990) Starch gel electro-phoresis and species distinctions. En SchreckC, Moyle PB (Eds) Methods for fish biologyAmerican Fisheries Society. USA. pp. 141-170.
López-Rojas H (1982) An analysis of the exter-nal form of the catfishes (Siluriformes: Te-leostei) PhD Dissertation. Duke University.Durham, NC. USA. 155 pp.
López-Rojas H (1992) The diagraph: An instru-ment for the use in three dimensional mor-phology of fishes. Acta Biol. Venez. 13: 117-123.
López-Rojas H, Marcano-Ch C, Brull O (1996)Los peces del refugio de Fauna SilvestreCuare (Falcón) y zonas adyacentes. Acta Biol.Venez. 16: 27-34.
Lundberg JG, Machado-Allison A, Kay R (1986)Miocene characid fish from Colombia: Evo-lutionary stasis and extirpation. Science 34:208-209.
Lundberg JG, Marshall LG, Guerrero J, HortonB, Malabarba MC, Wesselingh F (1998) TheStage for Neotropical Fish Diversification: AHistory of Tropical South American Rivers.En Malabarba L, Reis R, Vari R, LucenaZM, Lucena CA (Eds) Phylogeny and Clas-sification of Neotropical Fishes. EDIPUCRS,Porto Alegre. Brasil. pp: 13-48.
Machado-Allisson A, Fink W (1991) Notas sobrela sistemática del género Serrasalmus y gé-neros relacionados. Parte II. El género Pygo-centrus en Venezuela. Acta Biol. Venez. 13:109-136.
Machado-Allisson A, Fink W (1996) Los pecescaribes de Venezuela: Diagnosis, claves, as-pectos ecológicos y evolutivos. CDCH-UCV.Caracas, 149 pp.
Machado-Allisson A, Fink W, Antonio ME (1990)Revisión del género Serrasalmus LACEPEDE,1804 y géneros relacionados en Venezuela: I.Notas sobre la morfología y sistemática dePristobrycon striolatus (STEINDACHNER,1908). Acta Biol. Venez. 12: 140-171.
Mago-Leccia F (1970) Lista de los peces de Ve-nezuela. Ministerio de Agricultura y Cría.Caracas. 283 pp.
May B (1992) Starch gel electrophoresis ofallozymes. En Hoelzel AR (Ed) Moleculargenetic analysis of populations. A practicalapproach. IRL Press. pp. 1-27.
118 BONILLA118 BONILLA
MAR 2002, VOL. 27 Nº 3 127
Mayr E (1963) Animal Species and Evolution.Belknap Press. Cambridge, Mass. USA. 797pp.
McKay SI, Miller PJ (1991) Isozyme criteria inthe testing of phyletic relationship betweenspecies of Gobius and related eastern Atlan-tic-Mediterranean genera (Teleostei: Gobi-idae). J. Fish Biol. 39: 291-299.
Mickevich MF, Johnson MS (1976) Congruencebetween morphological and allozyme data inevolutionary inference and character evolu-tion. Syst. Zool. 25: 260-270.
Nei M (1972) Genetic distances between popula-tions. The American Naturalist 106: 283-292.
Nei M (1978) Estimation of average heterozigos-ity and genetic distances from a small num-ber of individuals. Genetics 89: 583-590.
Nixon SE, Taylor RJ (1977) Large genetic dis-tances associated with little morphologicalvariation in Polycelis coronata and Dugesiatigrina (planaria). Syst. Zool. 26: 152-164.
Provenzano F, Lasso C, Ponte V (1995) Neblin-ichthys roraima, a new species of armoredcatfish (Siluroidei:Loricariidae) from RioKukenán, Venezuela with considerations aboutbiogeography of the Guyana Shield. Ichth.Explor. Freshwaters 6: 243-254.
Richardson BJ, Baverstock PR, Adams M (1986)Allozyme Electrophoresis. A handbook foranimal systematics and population studies.Academic Press. 410 pp.
Ricklefs RE (1987) Community diversity: Rela-tive roles of local and regional processes.Science 325: 167-161.
Ricklefs RE (1988) Speciation and diversity: In-tegration of local and regional processes. EnOtte J, Endler JA (Eds) Speciation and itsConsequences. Sinauer, Sunderland, MA. pp:599-622.
Rod E (1981) Notes on the shifting course of theancient Rio Orinoco from late Cretaceous toOligocene time. GEOS 26: 54-56.
Schaefer A, Provenzano F (1993) The GuayanaShield Parotocinclus. Systematics, biogeog-raphy, and description of a new Venezuelanspecies (Siluroidei:Loricariidae). Ichth.Explor. Freshwaters 4: 39-56.
Schultz LP (1944) The fishes of the familyCharacinidae from Venezuela, with descrip-tions of seventeen new forms. Proc. US NatlMus. 95: 235-367.
Shaklee JB, Tamaru CS (1981) Biochemical andmorphological evolution of Hawaiian bone-fishes (Albula). Syst. Zool. 30: 125-146.
Shaklee JB, Allendorf FW, Morizot DC, WhittGS (1990) Gene nomenclature for protein-coding loci in fish. Trans. American Fisher-ies Soc. 1 19: 2-15.
Shaw CR, Prasad R (1970) Starch gel electro-phoresis of enzymes. A compilation of reci-pes. Biochemical Genetics 4: 297-320.
Stepien CA, Rosenblatt RH (1991) Patterns ofgene flow and genetic divergence in the
northeastern pacific Clinidae (Teleostei:Blennioidei), based on allozyme and mor-phological data. Copeia 1991: 873-896.
Strauss RE (1991) Correlations between het-erozygosity and phenotypic variability inCottus (Teleostei: Cotiidae): Character com-ponents. Evolution 45: 1950-1956.
Strauss RE, Bookstein FL (1982) The truss: bodyform reconstructions in morphometrics. Syst.Zool. 31: 113-135.
Swofford DL, Selander RB (1989) BIOSYS-1: aComputer Program for the Analysis of AllelicVariation in Population Genetic and Biochemi-cal Systematics, Release 1.7. Urbana IL: Univ.Illinois Natural History Survey. pp. 43.
Taphorn DC (1992) The Characiforms Fishes ofthe Apure River Drainage, Venezuela.Biollania Edición Especial No. 4. 537 pp.
Taphorn DC, Lilyestrom CG (1984) Clave paralos peces de agua dulce de Venezuela. Revis-ta Unellez de Ciencia y Tecnología 2: 5-30.
Triest L (1989) Electrophoretic polymorphismand divergence in Najas marina L.(Najadaceae): Molecular markers for indi-viduals, hybrids, cytodemes, lower taxa,ecodemes and conservation of genetic diver-sity. Aquatic Botany 33: 301-380.
Turner BJ (1974) Genetic divergence of Death Val-ley pupfish species: Biochemical versus mor-phological evidence. Evolution 28: 281-294.
Weitzman SH, Burns JR (1995) Glandulocaudinefishes. Tropical Fish Hobbyist. XLIV: 102-113.