Reporte de Quimica No. 5 Cota
Transcript of Reporte de Quimica No. 5 Cota
-
8/8/2019 Reporte de Quimica No. 5 Cota
1/5
UNIVERSIDAD DE SONORA
DIVISIN DE INGENIERIA
DEPARTAMENTO DE INGENIERIA INDUSTRIAL
REPORTE DE PRCTICA # 5
Enlace Metlico
MATERIA
Laboratorio de Qumica
Integrantes del equipo:
Aarn Rubn Domnguez Castillo
Brianda Renee Serna Villaescusa
Enrique Cota Ortega
Joaqun Amaury Lucero Nez
Ruth Martnez Andrade
Hermosillo, Sonora Martes, 19 de octubre 2010
-
8/8/2019 Reporte de Quimica No. 5 Cota
2/5
OBJETIVO
Verificar algunas propiedades fsicas y qumica de los metales.
INTRODUCCION
Para entender la prctica se necesitan ciertos conocimientos previos acerca de los
metales, mencionaremos a continuacin algunas de sus propiedades y caractersticas
tanto fsicas como qumicas.
Su principal caracterstica es que son brillantes y son maleables, esto quiere decir que se
pueden deformar sin romperse, adems son excelentes conductores de calor y
electricidad.
Qumicamente los metales forman iones positivos debido a su tendencia a ceder
electrones.
Propiedades de los metales:
Bajo poder de ionizacin.
Alto peso especfico.
Por lo general en su ltimo nivel de energa tienen 1 a 3 electrones.
Son slidos con 4 excepciones: mercurio, cesio, galio y francio, los que se
encuentran en estado lquido.
Son brillosos.
Buenos conductores de electricidad.
Dctiles y maleables.
Se oxidan al perder electrones.
Al unirse con oxgeno forman xidos y si esto reaccionan con agua forman
hidrxidos.
http://soopernova.com/mercurio/http://soopernova.com/mercurio/ -
8/8/2019 Reporte de Quimica No. 5 Cota
3/5
MATERIALES
-Un Mechero de Bunsen -Una Pinza para Tubo de Ensaye
-Tres Vasos de 250 ml -Un Tubo de Ensaye de 18x 150
-Un Agitador de Vidrio -Una Pipeta de 5 ml-Una Pinza para Crisol -Una Esptula
-Un Embudo de Plstico.
REACTIVOS
-Aluminio -Estao -Zinc
-Antimonio -Cobre -Plomo
-Fierro -Magnesio -Fenolftalena
-Cal -Agua destilada
METODOLOGIA (PROCEDIMIENTO)
1.- Utilizando un circuito, determine la conductividad elctrica de los siguientes
elementos: Fe, Cu, Sn, Al, Mg, Ag, Au, Zn, Sb, Pb.
2.- Enrolle un alambre de cobre (Cu) en un bulbo de termmetro, dejando libre un
extremo del alambre. Caliente con un encendedor ese extremo.
3.- Tome una tira de magnesio de 5 cm con unas pinzas para crisol. La punta libre
acrquela a la flama de un encendedor o de un mechero. Deposite la ceniza formada en
un tubo de ensaye de 18 x 150. Agrguele 3 ml de agua destilada y caliente suavemente
durante un minuto en la flama de un mechero. Retire el fuego y agregue 3 gotas de
fenolftalena.
4.- En un vaso de precipitado de 250 ml agregue un poco de cal (10 g aprox.) y disuelva
en unos 150 ml de H2O destilada. Filtre la solucin anterior con algodn una o dos
veces. Hasta que quede transparente. Luego agregue tres gotas de fenolftalena.
RESULTADOS
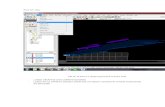
1.- Circuito:
-
8/8/2019 Reporte de Quimica No. 5 Cota
4/5
2.- Registre los siguientes datos:
Tiempo /
segundos0 10 20 30 40 50 60 70 80 90
Temperatura / C21 24 28 35 39 43 46 50 49 48
3.-
La tira de magnesio se quem rpido, su flama era brillante. Se puso de color rosa.
Reaccin: Mg + H2O = Hidrxido de magnesio.
4.- Se vuelve rosa oscuro.
Reaccin: agua destilada + cal = Hidrxido de calcio.
CUESTIONARIO
1.- Cul metal result mejor conductor de la corriente elctrica y cul peor?
El Oro resulto mejor conductor, y el Aluminio el peor.
2.- A qu se debe el incremento de temperatura aun despus de quitar el alambrede Cu de la fuente calorfica?
A que el cobre aun segua caliente, mientras tanto la temperatura aumentaba.
3.- Escriba las ecuaciones qumicas balanceadas de todas las reacciones efectuadasen la prctica.
H2O +Na = NaOH
METAL ENCIENDE?
AluminioLa bolita si, en la tablita en el centro no prenda y a los lados un
poco
Estao Si, encandila
Zinc si, no es molesto
Antimonio Si, mucho
Cobre Si muy fuerte
Plomo Si muy fuerte
Fierro Si (muy tenue)Magnesio
OroSi muy fuerte (encandila)Si Con gran fuerza!!
-
8/8/2019 Reporte de Quimica No. 5 Cota
5/5
Mg + H2O = Mg (OH) 2
H2O + Ca = Ca (OH) 2
4.- Menciona los componentes de cinco aleaciones comunes.
Acero: Hierro y Carbono.
Bronce: Cobre y Estao.
Latn: Cobre y Zinc.
Oro Blanco: Oro y un metal blanco.
Cupronquel: Cobre y Nquel.
5.- Menciones tres elementos que, adems de formar bases, tambin pueden
formar cidos dbiles bajo ciertas condiciones.
Zinc, Hierro y Magnesio.
CONCLUSIONES
Podemos concluir con esta prctica que podemos hacer reaccionar varias soluciones
(agua destilada). Pudimos observar que entre el aluminio, estao, zinc, antimonio,
cobre, plomo, fierro, magnesio y oro, el aluminio resulto el peor conductor de corriente
elctrica, mientras que el oro el mejor.
BIBLIOGRAFA
http://www.misrespuestas.com/que-es-la-oxidacion.html
http://es.wikipedia.org/wiki/wikipedia:portada
http://www.misrespuestas.com/que-es-la-oxidacion.htmlhttp://es.wikipedia.org/wiki/wikipedia:portadahttp://www.misrespuestas.com/que-es-la-oxidacion.htmlhttp://es.wikipedia.org/wiki/wikipedia:portada