Proteínas
-
Upload
universidad-xochicalco-facultad-de-medicina -
Category
Documents
-
view
188 -
download
3
Transcript of Proteínas

PROTEÍNAS

Se encuentran presentes en vegetales, animales y microorganismos participando en todos los procesos biológicos. En los animales por ejemplo se encuentra formando parte de los tejidos, músculos, piel, cabello, hormonas, etc.
Son macromoléculas muy complejas formadas por la unión de aminoácidos. Contienen en su composición carbono, oxígeno, hidrógeno y nitrógeno en su mayoría y en menor proporción azufre, fósforo, entre otros.
Un aminoácido (aa) es la unidad estructural básica de una proteína, es una molécula formada por un carbono alfa (α), que también es quiral (excepto glicina), enlazado a un hidrógeno, una cadena lateral R, un grupo carboxilo y un grupo amino.

Existen aproximadamente 300 aminoácidos, pero sólo 20 se encuentran en las proteínas y 10 de ellos se consideran esenciales.
Esenciales: Se deben obtener de los alimentos: Fenilalanina (Fen), isoleucina (Ile), leucina (Leu), metionina (Met), lisina (Lis), triptófano (Trp), treonina (Tre) y valina (Val). La arginina (Arg) e histidina (His), son esenciales sólo durante la infancia.
No esenciales: Pueden ser producidos por el cuerpo humano y son: glicina (Gli), alanina (Ala), serina (Ser), cisteína (Cis), tirosina (Tir), acido glutámico (Glu), ácido aspártico (Asp), glutamina (Gln), asparagina (Asn) y prolina (Pro).

PROPIEDADES ACIDO-BASE
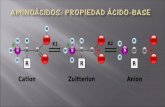
Dado que todos los aminoácidos poseen un grupo ácido (-COOH) y un grupo básico (-NH2), todos los aminoácidos libres presentan características
ácido-base.

CLASIFICACIÓN DE LOS AMINOÁCIDOS (En base al grupo R)
R= Grupos No polares (grupos alifáticos)

R=Grupos aromáticos

R=Grupos polares sin carga

R=Grupos polares con carga positiva (o básicos)
=NH3
+

R= Grupos polares con carga negativa (o ácidos)

ESTRUCTURA DE PROTEINASLas proteínas se forman por la unión de un grupo carboxilo de una aminoácido a un grupo amino de otro aminoácido.

Péptido (oligopéptido):Unión de una serie de aminoácidos (menos de 10). Dos: dipéptido, Tres: tripéptido, etc.
Polipéptido: Entre 10 y 100 aminoácidos.
Proteína: Más de 100 aminoácidos.

Tetrapéptido: Lys-Gly-Glu-Ala-

ESTRUCTURAS DE LA PROTEÍNAS (niveles de organización)

Estructura primariaEs la secuencia lineal de residuos de aminoácidos presentes, donde cada uno está unido al otro mediante un enlace peptídico.

Estructura secundariaLa cadena de aminoácidos adopta una disposición muy estable en forma de espiral. Pueden ser dos: α-hélice y β-laminar.La α-hélice se enrolla de manera que toma una disposición helicoidal, su estabilidad se debe a los puentes de H formados entre cada 4 aminoácidos. En la β-laminar todos los enlaces peptídicos se unen por puentes de H cruzados, lo que le da una forma de lámina plegada y estabilidad.

Estructura terciariaLa forma global de la cadena polipeptídica se conoce como su estructura terciaria.

Estructura cuaternariaMuestra la disposición espacial que adopta una proteína para cumplir con la función que le es propia. Aquí están involucradas varias proteínas para formar un complejo.

Clasificación en base a características físicas:Fibrosas: En forma de hilos, tienden a entrelazarse. Función estructural, son insolubles en agua. Ej: queratina, elastina, colágeno, miosina y fibroína.
Globulares: Moléculas dobladas, forman una unidad compacta de forma esférica. Solubles en agua, cumplen con funciones de mantenimiento y regulación de procesos metabólicos. Ej: hormonas, enzimas, anticuerpos.
La forma que adoptan se mantiene por medio de fuerzas intramoleculares (puentes de H o disulfuro). Si se altera el pH, temperatura, salinidad e incluso radiaciones UV pueden romper estos enlaces y desnaturalizar la proteína.
La desnaturalización es un proceso en donde la proteína pierde su estructura tridimensional por lo que sus propiedades y funcionamiento se ven afectadas. Puede causarse por pH del medio, salinidad o condiciones extremas de temperatura.

Clasificación de proteínas de acuerdo a su función
Catalizadora. Catalizan las reacciones metabólicas del organismo (enzimas)Estructural. Forma parte de la estructura de seres vivos (colágeno, queratina)Defensa. Protegen al cuerpo de agentes extraños (anticuerpos)Regulación u hormonal. Regulan actividades en cuerpo (metabolismo) y concentración de sustancias (insulina) Transporte. Transportan sustancias atravesando membranas (hemoglobina)Movimiento. Responsables del movimiento de los animales (actina y miosina)Almacenamiento. Almacenan sustancias necesarias para el cuerpo (ferritina)Receptoras. Presentes en la membrana plasmática, permiten interacción de diversas sustancias con la célula.