Practica 3 organica
Transcript of Practica 3 organica

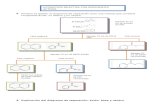
Resultados
Experiencia A: Extracción
Experiencia B: Variación del pH
Reacción
+
++ +
Solubilizados en H2O
Sacarosa Ácido benzoico
Éter etílico
+H2O +
SacarosaÁcido
benzoicoÉter etílico
Fase etéreaFase acuosa
++ NaOH +H2O+
++ NaOH H2O
Ácido benzoico
Benzoato de Sodio

Experiencia D: Extracción de Carotenos
Para la extracción de los carotenos se hizo una mezcla de benceno, hexano y metanol en partes igual se agrego a las espinacas y se macero hasta obtener un sustancia pigmentada posteriormente se lavo la capa orgánica para tratar de obtener los carotenos lo más puro posibles.
Análisis de Resultados
Experiencia A
En la primer extracción se hizo un mezcla de sacarosa, ácido benzoico y se solubilizo en agua; al adicionar el éter etílico se pudo observar la formación de dos fases, una acuosa y otra etérea, dentro de la acusa se encontraba la sacarosa y en la etérea al ácido benzoico esto se debió a que el acido benzoico tiene afinidad por el éter gracias a sus características físicas de solubilidad y la sacarosa con el agua. Posteriormente pasamos a separar las mezclas en un embudo de separación lo cual se logra gracias a la diferencia de densidades entre las fases, la fase orgánica fue destila para lograr recuperar el éter y tener como residuo al acido benzoico.
Experiencia B
En el desarrollo de la experiencia b se tuvo una mezcla de sacarosa y ácido benzoico solubilizados en con un solución de NaOH al 10 % con un pH=12, en esta experiencia a diferencia de la experiencia anterior se logra hacer soluble al acido benzoico en agua con la reacción entre este y el NaOH generando un Benzoato de Sodio el cual gracias a sus características iónicas se hace soluble en el agua, por lo tanto al adicionar el éter etílico se siguen formando dos fases, una acuosa y la otra etérea, pero en la fase etérea solo se va a encontrar el éter etílico y en la otra fase encontraremos el benzoato de sodio y la sacarosa, eso se comprueba al destilar la fase orgánica y observar que no obtenemos ningún residuo
Experiencia D
Para la extracción de carotenos se utiliza una mezcla de tres diferentes solventes esto para maximizar la cantidad de pigmentos (carotenos) extraídos en el proceso de maceración, esto para no correr el riesgo de no poder capturar ciertos solutos que pudieran diferir en la solubilidad de un solo solvente. Es importante mencionar que la cantidad de pigmento extraído depende de la trituración inicial de la muestra ya que el solvente penetra mejor, por lo cual se obtiene más sustancia al final, también afecta la

relación entre la cantidad de masa de la trituración y la cantidad de solvente, entre más solvente haya con respecto al vegetal se puede extraer más de este. Es más eficiente realizar muchas extracciones.
Conclusión
En una extracción del tipo fisicoquímica, se requiere que los 2 líquidos sean inmiscibles, se usa una fase acuosa y una orgánica no inmiscible que es más densa o menos densa que la acuosa, todo esto para lograr la separación de dos líquidos de manera eficaz, durante el proceso de extracción liquido-liquido se puede concluir que es un factor muy importante conocer la solubilidad de las sustancias para así poder elegir bien cual liquido va a extraer a cierto liquido, de igual modo como se menciona al inicio de este párrafo es necesario que los líquidos extractores sean inmiscibles para así poder lograr la separación especifica.
En el caso de lo extracción de los carotenos se realizo un extracción mediante el uso de solventes estos al ser usados en la maceración de las espinacas penetran por acción de la trituración y extraen los carotenos pero podemos concluir que entre más cantidad de solvente se utilice la cantidad de pigmentos obtenidos será mayor.

Instituto Politécnico Nacional
Escuela Nacional de Ciencias
Biológicas
Químico Farmacéutico Industrial
Laboratorio de Química Orgánica I

Docente: Luis Almazán Sánchez
Miguel Lázaro Guevara
Equipo 18: Jesús Ayala Velasco
Alma Carbajal Rodríguez
Grupo: 2FM1 Sección: II
29 de Marzo de 2011
Practica #3
Extracción Líquido – Líquido
Fundamentos:
Extracción:Se puede definir como la transferencia de una sustancia X desde un disolvente A, a un disolvente B con el cual es inmiscible. Extrayéndose, la sustancia X, por un proceso de distribución. La extracción puede ser un método tanto de separación como de purificación. Los tipos en general de extracciones son:
Selectiva: se emplea para separar mezclas de compuestos orgánicos, en función de la acidez, de la basicidad o de la neutralidad de éstos.

Simple: se utiliza todo el disolvente en una solo operación de extracción. Múltiple: se divide el disolvente en varias porciones iguales para hacer
extracciones sucesivas.
Constante de partición:
El soluto se distribuye entre las dos fases hasta lograr un equilibrio.
[A]o ↔ [A]aq
A la relación de concentraciones de cada fase se le Denomina cantante de distribución (o de partición):
K = CB /CA
Carotenos: Generalmente se conoce como caroteno al compuesto químico llamado más específicamente β-caroteno. Este es el carotenoide más abundante en la naturaleza y el más importante para la dieta humana, por lo que da su nombre a todo un grupo de compuestos bioquímicos. Son responsables de la gran mayoría de los colores amarillos, rojos y anaranjados de alimentos vegetales así como también de alimentos para animales.
El β-caroteno se emplea mucho como colorante alimentario, al ser insoluble en agua no es fácil de utilizar, como por ejemplo para colorear bebidas refrescantes q es una de sus aplicaciones. Su color amarillo-anaranjado se debe al anillo de ciclohexano insaturado en su estructura química.
Estructura del α-Caroteno
Estructura del β-Caroteno.

Estructura del ε-Caroteno
Estructura del ζ-Caroteno
Licopenos:Generalmente se conoce como caroteno al compuesto químico llamado más específicamente β-caroteno. Este es el carotenoide más abundante en la naturaleza y el más importante para la dieta humana, por lo que da su nombre a todo un grupo de compuestos bioquímicos. Son responsables de la gran mayoría de los colores amarillos, rojos y anaranjados de alimentos vegetales así como también de alimentos para animales.
El licopeno se obtiene principalmente de fuentes naturales como hongos y especialmente los tomates; sin embargo los sistemas de extracción son costosos y el licopeno presenta una baja estabilidad lo que ha bajado su utilidad como colorante alimenticio.
Una diferencia fundamental entre la estructura del licopeno y el β-caroteno es que los anillos de los extremos se encuentran abiertos; de hecho el licopeno es el precursor biosintético del β-caroteno en el tomate, el licopeno no tiene actividad como vitamina A como tal.
Sus propiedades del licopeno son variadas, como pueden ser:
Gran poder antioxidante, protege a las células humanas del estrés oxidativo. Además, actúa modulando las moléculas responsables de la regulación del ciclo
celular y produciendo una regresión de ciertas lesiones cancerosas.

Emulsiones
Con frecuencia se forman emulsiones durante el proceso de extracción. Estas pueden romperse mediante:
Un movimiento de giro suave al líquido del embudo Agitación vigorosa de la capa emulsionada Agitar la fase acuosa con una disolución saturada de cloruro de sodio Centrifugación
Agentes desecantes químicos
Un desecante debe reunir ciertas condiciones:
No reaccionar con la sustancia que se va a secar Ser eficaz, o sea, tener alto poder desecante; esto es, eliminar el agua
completamente o casi completamente cuando se alcanza el equilibrio. Tener gran capacidad de desecación, es decir, eliminar una gran cantidad de agua
por unidad de peso de desecante. Secar rápidamente Separarse fácilmente de la sustancia una vez seca
Los desecantes químicos pueden dividirse en dos grupos:
Aquellos que reacciona químicamente con el agua en un proceso no reversible lo cual da lugar a un nuevo compuesto libre de agua
Los que se combinan reversiblemente con el agua para formar un hidrato