Leucemia
-
Upload
drmiguelpoblete -
Category
Education
-
view
1.005 -
download
2
description
Transcript of Leucemia

Dra. Cecilia Luengo Dr Mauricio Ocqueteau. Julio,2001 DEFINICION Podemos definir las Leucemias Agudas, como enfermedades hematológicas malignas que resultan de la alteración en la proliferación y diferenciación de un grupo de células inmaduras, de estirpe mieloide o linfoide, hasta reemplazar completamente la Médula Ósea (MO). La pérdida de la MO y sangre periférica normal, produce los síntomas característicos y sin tratamiento, la muerte ocurre en pocos meses. Desde el punto de vista de laboratorio, hablamos de Leucemia cuando la población de blastos corresponde a más de un 20% de las células en una muestra, ya sea mielograma o biopsia de MO. INCIDENCIA Se estima que se producen aprox 2.3/100000 casos nuevos por habitantes/año de Leucemia Mieloide Aguda (LMAg) y éstos aumentan con la edad, alcanzando un peak de 12.6/100000 alrededor de los 65 años. En cuanto a las Leucemias Linfáticas Agudas (LLAg), se diagnostican aprox 3000-4000 casos nuevos al año y aunque también aumentan con la edad, su incidencia mayor se encuentra en población infantil y adultos jóvenes. Existe un leve predominio en el sexo masculino (2.9 v/s 1.9 en sexo femenino). ETIOLOGIA No existe una sola etiología que dé cuenta de todas las Leucemias, sino que se postulan varios mecanismos que podrían llevar a su producción; dentro de éstos, podemos citar: alteraciones genéticas, exposición a radiación, químicos y virus. Hereditaria Existe una predisposición genética; en casos de gémelos idénticos, la probabilidad de presentar leucemia es 5 veces mayor que la población general, si el otro gemelo padece la enfermedad. Asimismo, ciertas enfermedades congénitas, con alteración de la cromatina (cromatina inestable), se asocian con riesgo aumentado de leucemia: Anemia de Fanconi, Sd

de Bloom, Sd Ataxia-telangectasia, Agamaglobulinemia Congénita, Sd Down, Sd Klinefelter. Radiación Se ha descrito un número mayor de casos de leucemia en la población que estuvo expuesta a la radiación de las bombas nucleares en la 2� Guerra Mundial, alcanzando su peak a los 5-7 años post radiación. También se ha visto una mayor incidencia en pacientes expuestos a radioterapia (Rxt), como tratamiento de otro tumor maligno, especialmente con altas dosis de Rxt, acumuladas en períodos cortos y en personas jóvenes. Químicos Se ha asociado a derivados del benceno, como kerosene y tetracloruro de carbono, con mayor incidencia de LMAg y a exposición a tabaco y pesticidas con un riesgo mayor de LLAg. Drogas La asociación principal, es con medicamentos usados en el tratamiento de otros cánceres (Qxt), variando su incidencia y mecanismo de producción, según el tipo de droga específica.
a)agentes alquilantes: (Melfalán) 3-10% de los pac tratados, desarrollan LMAg, aprox 4-6 años post exposición; 2/3 aparecen 1� como Mielodisplasias y de éstas, 1/3 avanza al estado de leucemia. Producen alteraciones de los cromosomas 5 y 7. b) inhibidores de topoisomerasa II: ( Etopósido, Doxorrubicina) el desarrollo de leucemias se produce alrededor de 1 a 3 años post exposición y se relaciona con alteraciones del cromosoma11, que pueden detectarse incluso a 1,5 meses de iniciado el tratamiento; los tipos de leucemias corresponden generalmente a LMAg (M5 o LPA). c) inmunosupresores y factores de crecimiento: Ciclosporina y G-CSF, cuando son utilizados por períodos largos, mayores a 1 año, se asocian a alteraciones del cromosoma 7. También se han reportado asociaciones al uso de fenilbutazonas, CAF y Cloroquina. d) virus: no se han establecido relaciones directas, excepto en 2 formas raras de leucemia: Leucemia de Células Peludas y Leucemia de células T, asociadas a retrovirus.
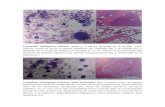
CLASIFICACION Durante años, las leucemias se clasificaron de acuerdo sólo a su aspecto morfológico al microscopio y en base a algunas reacciones histoquímicas, lo que no siempre lograba un diagnóstico claro; la clasificación FAB (franco-americana-británica), se basa en estas características y aunque sigue siendo la más usada o la base de las clasificaciones, el desarrollo de nuevas técnicas, como la inmunohistoquímica, citogenética y biología molecular, han permitido reconocer algunas alteraciones más específicas, llevando a un diagnóstico más acertado, lo que no sólo ha sido un aporte en la clasificación, sino en el

desarrollo de tratamientos dirigidos a estas alteraciones, diferencias pronósticas y al seguimiento más minucioso de las eventuales recaídas en pacientes ya tratados. Morfológica e Histoquímica (FAB) Se basa en las características señaladas y divide a las LMAg en 9 subtipos (M0- M7) y a las LLAg en 3 subtipos (L1-L3). Inmunofenotipo Usa la citometría de flujo, anticuerpos monoclonales v/s antígenos de superficie celular; se ha visto que en general estos antígenos son los mismos de las células hematopoyéticas normales en diferenciación, pero con patrones claramente aberrantes, que es lo que finalmente las diferencia. Citogenética Se basa en la detección de alteraciones a nivel de los cromosomas, ya sea en cuanto a número (ploidía) y/o estructura (deleciones, translocaciones, etc). Sólo 2 alteraciones se han vinculado a un tipo específico de leucemia: t(15:17)=M3 o LPA ; inv(16)=M4E0, ambas de buen pronóstico. Algunas alteraciones de mal pronóstico son: monosomía o deleción de los cromosomas 5 y 7 o trisomía del cromosoma 8. Podemos decir que, en general, las alteraciones cromosómicas asociadas a LMAg, corresponden a genes que codifican factores de transcripción de DNA o bien, la regulan, modificando el “destino” celular; menos frecuentemente, corresponden a alteraciones de factores de crecimiento. En LLAg, 60-75% tienen alteraciones genéticas, de ploidía o estructura, siendo el factor pronóstico más importante, ya que las características clínicas y de laboratorio de buen o mal pronóstico, se correlacionan con ellas. Por ejemplo, la t(9:22) o cromosoma Philadelphia (Ph+), es una alteración de mal pronóstico, encontrándose en un 5% de las LLAg infantiles; en cambio, está presente en un 25% de las LLAg en adultos. Se asocia con menor porcentaje y duración de Remisión Completa (RC) y mayor compromiso del SNC. Al contrario, el hallazgo de hiperploidía (más de 50 cromosomas), es una alteración de buen pronóstico y está presente en un 30% de las LLAg en niños, mientras que sólo se encuentra en un 2-5% de las LLAg en adultos. Molecular Da cuenta de los productos de los genes implicados en la leuquemogénesis,por ejemplo t(15:17) da como resultado, la producción de una proteína quimérica, con alteración del receptor del Ac Retinoico. El ATRA, actúa bypaseando esta alteración, constituyéndose en uno de los pilares fundamentales del tratamiento de la M3. Por el contrario, se sabe que la presencia de t(11:17), da como resultado un producto que confiere resistencia al ATRA. CLINICA

Los síntomas y signos de las leucemias son inespecíficos y están dados por el reemplazo de la MO y sangre periférica por blastos atípicos. Es frecuente que los pacientes hayan presentado síntomas más de 3 meses antes de que se realice el diagnóstico de la enfermedad. Lo más característico es la presencia de fatiga (50%), debilidad, anorexia, baja de peso, fiebre (con o sin infección asociada), hemorragias (más frecuentes y severas en M3 =GI, alveolar, SNC), dolor óseo, adenopatías, infiltración de tejidos blandos, hepato y/o esplenomegalia. En cuanto a los hallazgos de laboratorio, destacan anemia, de mayor o menor cuantía, generalmente normocítica-normocrómica, eritropoyesis inefectiva, con disminución del recuento de reticulocitos. En promedio, el recuento de glóbulos blancos se encuentra alrededor de 15000, aunque un 25-40% lo tiene menor a 5000; 20% de los pacientes, se presentan con recuentos mayores a 100000 y menos del 5% tiene lo que se conoce como leucemia “aleucémica”, es decir, sin blastos en la periferia. Las plaquetas en general, están disminuídas (75% menor a 100000), con un 25% en un rango severo ( menor a 25000). EVALUACION PRE TRATAMIENTO
Una vez realizado el diagnóstico de Leucemia, hay una serie de consideraciones a tomar previo al inicio del tratamiento con Qxt. Deben realizarse estudios para establecer el subtipo de leucemia, caracterizándola lo mejor posible, ya que como hemos señalado, incide directa e importantemente en el tipo de tratamiento a emplear y en la probabilidad de sobrevida del paciente. Es conveniente evaluar la integridad y función de los sistemas cardiovascular, pulmonar, hepático y renal, ya que varias de las drogas utilizadas en Qxt tienen efectos deletéreos sobre ellos. Asimismo, se recomienda obtener y criopreservar muestras celulares de todo paciente. Debe descartarse la presencia de infección y tratarse ésta de encontrarse, antes de iniciar cualquier tratamiento. En casos en que sea necesario (anemia severa, hemorragias importantes), pueden realizarse transfusiones de glóbulos rojos, plaquetas o plasma. El 50% de los pacientes tiene hiperuricemia al momento del diagnóstico, alcanzando niveles significativos en un 10%; esto aumenta con la Qxt, pudiendo producirse precipitación a nivel renal, con nefropatía severa. Por esto, se recomienda hidratar en forma importante a los pacientes previo a la Qxt, el uso de Alopurinol (300-600mg/d) y alcalinizar la orina. El compromiso del SNC es poco frecuente en LMAg; por lo tanto, no se justifica el realizar PL diagnóstica a todo paciente, sino sólo a los que presenten síntomas sospechosos (cefalea,

letargo, alteración mental). Tampoco se realiza profilaxis 1aria del SNC en LMAg. FACTORES PRONOSTICOS Lo más importante es alcanzar Remisión Completa (RC) de la enfermedad. Esto significa: recuento leucocitario mayor o igual a 1500, plaquetas mayor a 100000 y ausencia de blastos periféricos; el hto y la hb no son significativos. En cuanto a MO, debe existir maduración trilinear mayor al 20%, menos de 5% de blastos y ausencia de corpúsculos de Auer (característicos de LMAg). Todo esto debe mantenerse por un plazo mínimo de 4 semanas, para considerarse RC. Deben realizarse PCR e inmunofenotipo para detectar enfermedad residual, ya que si bien, estas técnicas aún no están consideradas dentro del diagnóstico de RC, son tremendamente importantes a la hora de decidir mayor tratamiento y predicen la duración de RC y por ende, una eventual recaída. Existen factores que se asocian con una mayor o menor probabilidad de alcanzar RC; estos son:
-Edad: a mayor edad al Dg (mayor de 60 años), peor pronóstico, ya que estos pacientes sobreviven menos a las terapias de inducción y expresan antígenos que les confieren resistencia a las antraciclinas (bomba mdr1). -Status funcional y patologías asociadas. -Patologías agudas intercurrentes -Hallazgos cromosómicos al diagnóstico. -Historia de síntomas prolongados, con pancitopenia mayor a 1 mes. -Antecedentes de patología hematológica previa ( LMAg 2arias o Mielodisplasias previas, son menos respondedoras a los tratamientos Qxt). -Alto recuento leucocitario al dg (mayor a 100000) y mayor número de blastos periféricos. Se asocian con mayor compromiso del SNC y linfangitis pulmonar). -Clasificación FAB, inmunofenotipo.
TRATAMIENTO Tanto en la LMAg como en la LLAg, el tratamiento se basa en Quimioterapia (Qxt) y las drogas se administran de acuerdo a protocolos establecidos. En todos ellos, existe una fase de Inducción, cuyo objetivo es lograr la RC y otra fase de Consolidación, que da cuenta de la sobrevida libre de enfermedad, ya que sin ella, la mayoría de los pacientes recae, en

un tiempo promedio de 4 meses. El riesgo de recaída es mayor los primeros 2 años post consolidación y también tiene importancia pronóstica, ya que una recaída temprana (durante los 1�s 18 meses) tiene menor sobrevida. Si la sobrevida libre de enfermedad supera los 5 años de seguimiento, podemos hablar de curación. LMAg Inducción: 7 días de Citarabina + 3 días de Daunorrubicina; tienen un 60-80% de RC en menores de 60 años y 50% en mayores de 60. Se ha intentado aumentar las dosis de Citarabina, pero no se ha visto aumento en el porcentaje de RC y sí un aumento en la toxicidad, principalmente neurológica .Protocolos que usan Idarrubicina, en lugar de Daunorrubicina han reportado menor toxicidad, sin variación en la RC; el uso adicional de Etopósido, en algunos trabajos, habría incrementado el tiempo en RC. Postremisión: existen 3 alternativas, con resultados relativamente semejantes: TMO halógeno (50-60% curación) TMO autólogo (45-55% curación) Qxt (46% curación) LLAg Inducción: consiste en ciclos cortos (4-8) de asociación de drogas en que siempre se incluye un corticoide (prednisona o dexametasona) y generalmente Vincristina, Antraciclina; también altas dosis de Ciclofosfamida, Metrotrexato y Citarabina. Tratamiento profiláctico del SNC: A diferencia de la LMAg, aquí es importante realizar profilaxis del SNC, ya que el mayor porcentaje de recaídas, se produce en este sistema (35%), reduciéndose a menos de un 10% ( y hasta 2% en algunos protocolos) cuando se usa profilaxis. Esta consiste en la administración de drogas intratecales, generalmente Metrotrexato. Consolidación: se usa Metrotrexato o 6-mercaptopurina. Con este tratamiento, en niños se consigue un 95-99% RC, con 60-70% sobrevida libre de enfermedad y en adultos, 70-90% RC, con 25-50% sobrevida libre de enfermedad. Factores de buen pronóstico son la edad menor de 30 años, recuento de blancos menor a 30000 y ausencia de cromosoma Ph+. Transplante de Médula Ósea (TMO) Consiste en la aplicación de altas dosis de Qxt, con o sin Rxt, para la eliminación de todas las células neoplásicas, seguida del “injerto” de una MO, ya sea autóloga ( del mismo paciente) o halógena ( de otro individuo). Generalmente, su indicación está restringida a pacientes menores de 55 años, principalmente por la tolerancia y los riesgos de la inmunosupresión

extrema. Factores importantes de considerar son:
a)momento: mayor efectividad post 1� RC (sobrevida 45-55% a 5 años v/s 25% post 1� recaída). b) fuente: halógeno tiene pequeño mayor porcentaje de sobrevida, pero también mayor riesgo de Enfermedad Injerto contra huésped. Debe elegirse un familiar HLA compatible (presente en un 35% de los casos) y de preferencia no hombres mayores o mujeres multíparas; también debe evitarse el transplante de MO CMV+ en un paciente con serología negativa para CMV. c)preparación: erradicar toda enfermedad y suprimir el Sistema Inmune con la mínima toxicidad posible. Generalmente, se usa Ciclofosfamida más Rxt o Ciclofosfamida más busulfán. d) profilaxis: debe prevenirse la Enfermedad Injerto contra huésped; esto se logra por medio de inmunosupresores, como Metrotrexato o Ciclosporina. Se ha observado que su uso simultáneo es mejor que el cada una por separado. A veces también se usan corticoides.
Uso Factores de Crecimiento Dada la alta tasa de muerte durante la fase de Inducción ( sobretodo en pacientes mayores) debido a infecciones (15-25%),se ha evaluado el uso de Factores de Crecimiento para acelerar la recuperación hematopoyética y prevenir infecciones, como coadyuvante de la Qxt. Se ha observado que disminuye el tiempo de neutropenia, pero no se correlaciona con una menor tasa de infecciones ni con incremento en la duración de la RC o sobrevida libre de enfermedad. Por lo tanto, no tienen un rol claramente establecido y su uso se reserva para pacientes con infecciones serias, que no responden a tratamiento ATB.
BIBLIOGRAFIA 1. Principles of Internal Medicine, Harrison’s 15th edition. Capítulo 111 (706-715) 2. Acute Mieloid leukemia, NEJM vol 341, n� 14, Sept 1999 (1051-1062) 3. Acute Linphoblastic Leukemia, NEJM vol 339, n�9, Aug 1998 (605-615) 4. MDK Hematología Capítulo 4 (Leucemias) (69-91)

5. Up to Date , edición 9.1, 2001.