f[1].Basolo & r Johnson - Quimica de Los Compuestos de Coordinacion
isomeria de compuestos de coordinacion
-
Upload
jesus-guillen-campos -
Category
Documents
-
view
18 -
download
0
description
Transcript of isomeria de compuestos de coordinacion
Estereoisomera. Isomera pticaExisten sustancias que al ser atravesadas porluz polarizadaplana producen un giro del plano de vibracin de la luz. Se dice que estas sustancias presentanactividad ptica.Se llaman sustanciasdextrgiraslas que al ser atravesadas por una luz polarizada plana giran el plano de polarizacin hacia la derecha (segn un observador que reciba la luz frontalmente).Se llaman sustanciaslevgiraslas que al ser atravesadas por una luz polarizada plana giran el plano de polarizacin hacia la izquierda (segn un observador que reciba la luz frontalmente).La causa de la actividad ptica radica en la asimetra molecular. En qumica orgnica la principal causa de asimetra molecular es la presencia en la molcula de algn tomo de carbono asimtrico. El tomo de carbono asimtrico se caracteriza por estar unido a cuatro grupos diferentes. Se acostumbra a sealar los carbonos asimtricos con un asterisco cuando se quiere poner de manifiesto su carcter de carbonos asimtricos:En el caso de una molcula con un slo tomo de carbono asimtrico son posibles dos configuraciones distintas y tales que una cualquiera de ellas es la imagen especular de la otra. Estas configuraciones son recprocamenteenantiomorfas.
Configuraciones enantiomorfas(imgenes especulares)
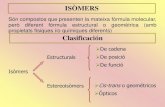
Losenantiomorfosson ismeros pticos, pues teniendo la misma frmula molecular slo se diferencian en su accin sobre la luz polarizada. Los enantiomorfos presentan las mismas propiedades qumicas y fsicas (excepto su accin sobre la luz polarizada). Una mezcla equimolecular (igual nmero de molculas) de dos enantiomorfos no presentar actividad ptica. A esta mezcla se le llamamezcla racmica.Tipos de isomeraLa isomera consiste en que dos o ms sustancias que responden a la misma frmula molecular presentan propiedades qumicas y/o fsicas distintas.Los distintos tipos de isomera se clasifican segn el siguiente esquema: Tipos de isomera
Isomera estructural o planaLa isomera estructural o plana se debe a diferencias de estructura y puede explicarse mediante frmulas planas.a) Isomera de cadenaEs la que presentan las sustancias cuyas frmulas estructurales difieren nicamente en la disposicin de los tomos de carbono en el esqueleto carbonado, por ejemplo:Ismeros con frmula molecular C4H10
n-butano2-metil-propano (isobutano)
b) Isomera de posicinEs la que presentan sustancias cuyas frmulas estructurales difieren nicamente en la situacin de su grupo funcional sobre el esqueleto carbonado.Veamos algn ejemplo:Ismeros con frmula molecular C3H8
1-propanol2-propanol
c) Isomera de funcinEs la que presentan sustancias que con la misma frmula molecular presentan distinto grupo funcional, por ejemplo:Ismeros con frmula molecular C2H6O
etanolmetano-oxi-metano
propanalpropanona
Estereoisomera: Isomera geomtricaLa estereoisomera la presentan sustancias que con la misma estructura tienen una diferente distribucin espacial de sus tomos.Una de las formas de estereoisomera es laisomera geomtrica. La isomera geomtrica desde un punto de vista mecnico, se debe en general a que no es posible la rotacin libre alrededor del eje del doble enlace. Es caracterstica de sustancias que presentan un doble enlace carbono-carbono:, as como de ciertos compuestos cclicos.Para que pueda darse en los compuestos con doble enlace, es preciso que los sustituyentes sobre cada uno de los carbonos implicados en el doble enlace sean distintos. Es decir, que ninguno de los carbonos implicados en el doble enlace tenga los dos sustituyentes iguales.Las distribuciones espaciales posibles para una sustancia que con un doble enlace son: Forma cis; en ella los sustituyentes iguales de los dos tomos de carbono afectados por el doble enlace se encuentran situados en una misma regin del espacio con respecto al plano que contiene al doble enlace carbono-carbono. Forma trans; en ella los sustituyentes iguales de los dos tomos de carbono afectados por el doble enlace se encuentran situados en distinta regin del espacio con respecto al plano que contiene al doble enlace carbono-carbono.Por ejemplo:Ismeros geomtricos para el compuestoCH3-CH=CH-COOH
Ismerocis(cido isocrotnico)Ismerotrans(cido crotnico)
De ordinario resulta ms fcil transformar la forma cis en la trans que a la inversa, debido a que en general la forma trans es la ms estable.Configuraciones y conformacionesComo acabamos de ver, al estudiar la isomera geomtrica, hay ocasiones en que una misma estructura molecular puede adoptardisposiciones espaciales diferentes y establesque resultan ser ismeros espaciales separables. Estas disposiciones espaciales diferentes y permanentes reciben el nombre deconfiguraciones.As las formascisytransde los ismeros geomtricos son distintas configuraciones de la misma estructura.La libre rotacin en torno a un enlace simple da lugar a que las molculas puedan adoptar un nmero infinito de distribuciones espaciales interconvertibles recprocamente sin ruptura de enlaces. Estas disposiciones espaciales, pasajeras, y que se interconvierten con tanta facilidad que no pueden aislarse ismeros espaciales reciben el nombre genrico deconformaciones.Dos o ms conformaciones diferentes de una misma molcula reciben la denominacin recproca derotmerosoconfrmeros.De las infinitas conformaciones posibles por libre rotacin en torno al enlace simple, no todas son igualmente probables, dependiendo de las interacciones entre los tomos de la misma molcula.En el etano, que es uno de los casos ms sencillos de considerar, las conformaciones ms notables son laalternaday laeclipsada. La siguiente figura muestra ambas conformaciones con distintos tipos de representaciones:Conformacin alternada
Proyeccin encaballeteProyeccin modificadade NewmanProyeccin deenlaces convencionales
Etano (C2H6)
Conformacin eclipsada
Proyeccin encaballeteProyeccin modificadade NewmanProyeccin deenlaces convencionales
La conformacin de mayor contenido energtico es la eclipsada debido a que la repulsin entre los tomos de hidrgeno es mxima, mientras que en la conformacin alternada es mnima.Isomera Geomtrica:Se presenta frecuentemente en entidades con NC 4 y estructura cuadrado planar, o con NC 6 y estructura octadrica, cuando existen dos o tres ligantes monodentados iguales entre s y diferentes a los dems, o cuando existen ligantes didentados asimtricos. En el caso de dos ligantes iguales, los ismeros se diferencian mediante los prefijoscis-ytrans-. El prefijocis-corresponde a dos ligantes iguales en posiciones vecinas, es decir, sobre el mismo lado en la estructura cuadrado planar, o sobre la misma arista en la estructura octadrica; el prefijotrans-indica que ocupan vrtices o posiciones opuestas entre sIsomera de coordinacin:Esta se presenta generalmente en sales complejas en donde tanto el catin como el anin son entidades de coordinacin y por lo tanto existe la posibilidad de obtener complejos en donde los iones centrales de las entidades se encuentren con unos ligantes en un caso y con ligantes intercambiados en el otro, por ejemplo:[Co(NH3)6[CrCl6],[CoCl(NH3)5][CrCl5(NH3)], [CrCl2(NH3)4][CoCl4(NH3)2], [Cr(NH3)6][CoCl6].Isomera de Enlace:Esta isomera no es muy comn y puede presentarse con ligantes monodentados que tienen ms de un tomo donor como SCN-o NO2-, en donde el ligante se puede unir al ion central por el S por el N, en el primer caso, y por el N o por el O en el segundoIsomera de Ionizacin:Hace referencia por lo general a sales complejas en donde la parte aninica puede ser un ligante potencial y en el ismero se intercambia con ligantes pertenecientes al catin complejo. En solucin, los ismeros dan lugar a iones diferentes

![f[1].Basolo & r Johnson - Quimica de Los Compuestos de Coordinacion](https://static.fdocuments.mx/doc/165x107/563db8cc550346aa9a970e3b/f1basolo-r-johnson-quimica-de-los-compuestos-de-coordinacion.jpg)