Inhibición enzimática
-
Upload
iselaprado -
Category
Documents
-
view
847 -
download
0
Transcript of Inhibición enzimática

IPRIPR
INHIBICIÓN ENZIMÁTICAINHIBICIÓN ENZIMÁTICA
BIBLIOGRAFÍA:
Bioquímica, Robert Roskoski, Jr. Editorial Mc Graw-Hill Interamericana. http://www.angelfire.com/ult/bioquimicae07/intentocucs.html

INHIBICIÓN ENZIMÁTICAINHIBICIÓN ENZIMÁTICA
• La actividad de las enzimas La actividad de las enzimas puede inhibirse. puede inhibirse.
• Las moléculas que reducen la actividad de una Las moléculas que reducen la actividad de una enzima, denominadas inhibidores, incluyen enzima, denominadas inhibidores, incluyen muchos fármacos, antibióticos, conservantes muchos fármacos, antibióticos, conservantes alimentarios y venenos. alimentarios y venenos.
• Las investigaciones de la inhibición enzimática Las investigaciones de la inhibición enzimática y de los inhibidores llevada a cabo por los y de los inhibidores llevada a cabo por los químicos son importantes por varías razones:químicos son importantes por varías razones:

RAZONESRAZONES
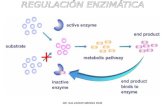
• La razón más importante, en los seres vivos la La razón más importante, en los seres vivos la inhibición enzimática es un medio importante inhibición enzimática es un medio importante para regular las rutas metabólicas.para regular las rutas metabólicas.
• Numerosos tratamientos clínicos se Numerosos tratamientos clínicos se fundamentan en la inhibición enzimática.fundamentan en la inhibición enzimática.
• El proceso de inhibición enzimática es útil El proceso de inhibición enzimática es útil para comprender los mecanismos de acción para comprender los mecanismos de acción tóxica y farmacológica de algunos tóxica y farmacológica de algunos compuestos.compuestos.

RAZONESRAZONES
• La inhibición enzimática puede producirse La inhibición enzimática puede producirse cuando un compuesto compite con el cuando un compuesto compite con el sustrato por el activo de la enzima libre, se sustrato por el activo de la enzima libre, se une al complejo ES en un lugar separado del une al complejo ES en un lugar separado del lugar activo, o se une a la enzima libre en un lugar activo, o se une a la enzima libre en un lugar separado del lugar activo. lugar separado del lugar activo.
• Ciertos metales como el plomo, Ciertos metales como el plomo, mercurio y arsénico inhiben enzimas mercurio y arsénico inhiben enzimas que tienen en su centro activo grupos que tienen en su centro activo grupos – SH libres – SH libres

COMPETITIVA
• Los inhibidores competitivos se unen de Los inhibidores competitivos se unen de forma reversible a la enzima libre, y no al forma reversible a la enzima libre, y no al complejo ES, para formar un complejo complejo ES, para formar un complejo enzima – inhibidor (EI).enzima – inhibidor (EI).
• Con frecuencia, el sustrato y el inhibidor Con frecuencia, el sustrato y el inhibidor compiten por el mismo lugar en la compiten por el mismo lugar en la enzima. La concentración del complejo EI enzima. La concentración del complejo EI depende de la concentración del inhibidor depende de la concentración del inhibidor libre y de la constante de disociación libre y de la constante de disociación

COMPETITIVA
• Debido a que el complejo EI se disocia Debido a que el complejo EI se disocia fácilmente, la enzima está disponible de fácilmente, la enzima está disponible de nuevo para unir al estrato. La actividad de la nuevo para unir al estrato. La actividad de la enzima disminuye debido a que no se enzima disminuye debido a que no se produce una reacción productiva durante el produce una reacción productiva durante el tiempo limitado que existe el complejo EI. tiempo limitado que existe el complejo EI.
• El efecto de un inhibidor competitivo sobre la El efecto de un inhibidor competitivo sobre la actividad puede invertirse aumentando la actividad puede invertirse aumentando la concentración de sustrato. A (S) elevadas, concentración de sustrato. A (S) elevadas, todos los lugares activados están llenos de todos los lugares activados están llenos de sustrato y la velocidad de reacción alcanza sustrato y la velocidad de reacción alcanza el valor que se observa sin un inhibidor. el valor que se observa sin un inhibidor.

Inhibición competitiva: el sustrato (S) y el inhibidor (I) compiten por el sitio activo

COMPETITIVA
• Las sustancias que se comportan como Las sustancias que se comportan como inhibidores competitivos, es decir, que inhibidores competitivos, es decir, que reducen la afinidad aparente de una reducen la afinidad aparente de una enzima por el sustrato, suelen tener una enzima por el sustrato, suelen tener una estructura semejante a la del sustrato. estructura semejante a la del sustrato. Entre estas moléculas hay productos de Entre estas moléculas hay productos de reacción o análogos que no se reacción o análogos que no se metabolizan, o derivados del sustrato. metabolizan, o derivados del sustrato.
• La succinato deshidogenasa, una enzima La succinato deshidogenasa, una enzima del ciclo del ácido cítrico de Krebs, del ciclo del ácido cítrico de Krebs, catalizan una reacción redox que catalizan una reacción redox que convierten el succinato en fumarato. convierten el succinato en fumarato.

NO COMPETITIVA• En algunos reacciones catalizadas por enzimas En algunos reacciones catalizadas por enzimas
el inhibidor puede unirse tanto a la enzima el inhibidor puede unirse tanto a la enzima como al complejo enzima – sustrato:como al complejo enzima – sustrato:
• En estas circunstancias, que se denominan En estas circunstancias, que se denominan inhibición no competitiva, el inhibidor se une a inhibición no competitiva, el inhibidor se une a un lugar diferente del lugar activo. un lugar diferente del lugar activo.
• La unión del inhibidor ocasiona la modificación La unión del inhibidor ocasiona la modificación de la conformación de la enzima que impide la de la conformación de la enzima que impide la formación del producto. Normalmente, los formación del producto. Normalmente, los inhibidores no competitivos no afectan a la inhibidores no competitivos no afectan a la unión del sustrato y se parecen poco o nada a unión del sustrato y se parecen poco o nada a éste. éste.

NO COMPETITIVA
• Como con los inhibidores acompetitivos, la Como con los inhibidores acompetitivos, la inhibición no competitiva sólo se invierte inhibición no competitiva sólo se invierte parcialmente aumentando la parcialmente aumentando la concentración de sustrato. concentración de sustrato.
• La inhibición no competitiva normalmente La inhibición no competitiva normalmente implica dos o más sustratos.implica dos o más sustratos.
• Las características de la inhibición que se Las características de la inhibición que se observan pueden depender en parte de observan pueden depender en parte de factores como el orden en el que se unen factores como el orden en el que se unen los diferentes sustratos. los diferentes sustratos.

ACOMPETITIVA
• En la inhibición acompetitiva, el inhibidor En la inhibición acompetitiva, el inhibidor sólo se une al complejo enzima – sólo se une al complejo enzima – sustrato, y no a la enzima libre.sustrato, y no a la enzima libre.
• La adicción de más sustrato a la reacción La adicción de más sustrato a la reacción da lugar a un aumento de la velocidad de da lugar a un aumento de la velocidad de reacción, pero no hasta el grado que se reacción, pero no hasta el grado que se observa en las reacciones sin inhibir. observa en las reacciones sin inhibir.
• La inhibición acompetitiva suele La inhibición acompetitiva suele observarse en las reacciones en las que observarse en las reacciones en las que las enzimas unen más de un sustrato.las enzimas unen más de un sustrato.

REVERSIBLE
• En la inhibición reversible (es decir, En la inhibición reversible (es decir, inhibición competitiva, acompetitiva y no inhibición competitiva, acompetitiva y no competitiva), el inhibidor puede competitiva), el inhibidor puede disociarse de la enzima debido a que se disociarse de la enzima debido a que se une mediante enlaces no covalentes.une mediante enlaces no covalentes.
IRREVERSIBLE
• Los inhibidores irreversibles Los inhibidores irreversibles normalmente se unen covalentemente a normalmente se unen covalentemente a la enzima, con frecuencia a una cadena la enzima, con frecuencia a una cadena lateral del lugar activo.lateral del lugar activo.

REVERSIBLE
Esquema cinético para los inhibidores enzimáticos reversibles

IRREVERSIBLE
Kinetic scheme for irreversible inhibitors.
Como se muestra en la figura en la izquierda, los inhibidores irreversibles forman un complejo con la enzima reversible y no covalente (EI o ESI) y esto

ALOSTÉRICA
• La mayoría de las enzimas alostéricas son La mayoría de las enzimas alostéricas son proteínas con varias subunidades. proteínas con varias subunidades.
• La unión del sustrato a un protómero en una La unión del sustrato a un protómero en una enzima alostérica afecta a las propiedades de enzima alostérica afecta a las propiedades de unión de los protómeros adyacentes. unión de los protómeros adyacentes.
• La actividad de las enzimas alostéricas se ve La actividad de las enzimas alostéricas se ve afectada por moléculas efectoras que se afectada por moléculas efectoras que se unen a otros lugares denominados lugares unen a otros lugares denominados lugares alostéricos o reguladores. Las enzimas alostéricos o reguladores. Las enzimas alostéricas generalmente catalizan pasos alostéricas generalmente catalizan pasos reguladores clave de las rutas bioquímicas.reguladores clave de las rutas bioquímicas.