Informe Lab 3 Quimica
-
Upload
anonymous-2g6eeuvy -
Category
Documents
-
view
245 -
download
2
description
Transcript of Informe Lab 3 Quimica

UNIVERSIDAD NACIONAL DE INGENIERIA
FACULTAD DE INGENIERIA GOLOGICA MINERA Y METALURGICA
INFORMETercer Laboratorio de Química I
QU113-R
Ing.SESPEDES VALKARSEL SVITLANA
NOMENCLATURA INORGÁNICA Y PROPIEDADES DE ALGUNAS SUTANCIAS
Integrantes:
BustinzaAgramonte Alex Valentín 20112620E
Cardenas Melo Leslie Helen 20111331J
Melgarejo MagariñoGian Carlo 20112649C
LIMA – PERÚ
2011 - II

INTRODUCCION
Para obtener información acerca de una sustancia dada, es necesario conocer su fórmula química y su nombre. Los nombres y las fórmulas de los compuestos son parte del vocabulario fundamental de la química. La asignación de nombres a las sustancias se denomina nomenclatura química. Se conocen más de 19 millones de sustancias químicas. Nombrarlas todas sería una tarea abrumadoramente complicada si cada una tuviera un nombre especial independiente de todos los demás. Para la mayor parte de las sustancias nos apoyamos en un conjunto sistemático de reglas que nos llevan a un nombre único e informativo para cada sustancia, con base en su composición.Las reglas de la nomenclatura química se basan en la división de las sustanciasen diferentes categorías. La división principal es entre los compuestos orgánicos y los inorgánicos. Entre estos compuestos consideraremos tres categorías de sustancias: compuestos iónicos, compuestos moleculares y ácidos.Existen dos clases de nombres en la nomenclatura química: el nombre común o clásico y el nombre sistemático. La nomenclatura química de los compuestos está dada por la IUPAC que periódicamente revisa y actualiza las reglas.

OBJETIVOS
Aprender a nombrar correctamente los compuestos
inorgánicos y escribir sus fórmulas de forma correcta.
Reconocer de acuerdo a la formula respectiva a qué
tipo de compuesto pertenece.
Estudiar los diferentes métodos de obtención de los
compuestos inorgánicos.
Estudiar algunas propiedades químicas de metales, no
metales, óxidos, hidróxidos, ácidos y sales.

FUNDAMENTO TEORICO
Nombres y fórmulas de compuestos iónicosLos compuestos iónicos por lo regular consisten en combinaciones químicas de metales y no metales. Los metales forman los iones positivos, y los no metales, los negativos.
1. Iones positivos (cationes)a) Los cationes que se forman a partir de átomos metálicos tienen el
mismo nombre queel metal.
Na+ion sodio Zn+ion zinc Al3+ion aluminioLos iones que se forman a partir de un solo átomo se llaman iones monoatómicos.
b) Si un metal puede formar cationes con diferente carga, la carga positiva se indica con un número romano entre paréntesis después del nombre del metal:
Fe2+ ion hierro (II) Cu+ ion cobre (I)Fe3+ ion hierro (III) Cu2+ ion cobre (II)
Los iones con diferente carga tienen diferentes propiedades, como el color. Un método más antiguo que todavía se usa mucho para distinguir entre dos iones de un metal con carga diferente es aplicar la terminación -oso o -ico. Estas terminaciones representan los iones con carga menor y mayor, respectivamente, y se agregan a la raíz del nombre del elemento.
Fe2+ ion ferroso Cu+ ion cuprosoFe3+ ion férrico Cu2+ ion cúprico
c) Los cationes formados a partir de átomos no metálicos tienen nombres que terminan en -io:
NH4 ion amonio H3O+ ion hidronio

2. Iones negativos (aniones)a) Los aniones monoatómicos tienen nombres que se forman
eliminando la terminación del nombre del elemento y agregando la terminación: -uro; en el caso del oxígeno la terminación es -ido:
H- ion hidruro O2- ion óxido N3- ion nitruroAlgunos aniones poliatómicos sencillos tienen también nombres que llevan estas terminaciones:
OH- ion hidróxido CN- ion cianuro O22- ion peróxido
b) Los aniones poliatómicos que contienen oxígeno tienen nombres que terminan en -ato o -ito. Estos aniones se llaman oxianiones. La terminación –ato se emplea para el oxianión más común de un elemento. La terminación -ito se usa para un oxianión que tiene la misma carga pero un átomo menos de O:
NO3- ion nitrato SO4
2- ion sulfatoNO2
- ion nitrito SO32- ion sulfito
Se emplean prefijos cuando la serie de oxianiones de un elemento se extiende a cuatro miembros, como es el caso de los halógenos. El prefijo per- indica un átomo de O más que el oxianión que termina en -ato; el prefijo hipo- indica un átomo de O menos que el oxianión que termina en -ito:
ClO4- ion perclorato (un átomo de O más que el clorato)
ClO3- ion clorato
ClO2- ion clorito (un átomo de O menos que el clorato)
ClO- ion hipoclorito (un átomo de O menos que el clorito)

c) Los aniones que se obtienen agregando H+ a un oxianión se designan agregando como prefijo la palabra hidrógeno o dihidrógeno, según resulte apropiado:
CO32- ion carbonato
HCO3- ion hidrógenocarbonato
PO43- ion fosfato
H2PO4- ion dihidrógeno fosfato
Observe que cada H+ reduce la carga negativa del anión original en 1. Un método antiguo para designar algunos de estos iones utiliza el prefijo bi-.Así, el ion HCO3
+ comúnmente se llama ion bicarbonato, y HSO4
- a veces se llama ion bisulfato.
3. Compuestos iónicosLos nombres de los compuestos iónicos consisten del nombre del anión seguido de la palabra “de” y el nombre del catión:
CaCl2 cloruro de calcioAl(NO3)3 nitrato de aluminioCu(ClO4)2 perclorato de cobre(II) (perclorato cúprico)
En las fórmulas químicas del nitrato de aluminio y el perclorato de cobre(II) se usan paréntesis seguidos del subíndice apropiado porque el compuesto contiene dos o más iones poliatómicos.
Nombres y fórmulas de ácidosLos ácidos son una clase importante de compuestos que contienen hidrógeno y se designan con un método especial. Por ahora, definiremos un ácido como una sustancia cuyas moléculas producen iones hidrógeno (H+) cuando se disuelve en agua. Cuando nos encontremos con la fórmula química de un ácido en esta etapa del curso, la escribiremos con el H como primer elemento, por ejemplo, HCl y H2SO4.Podemos considerar que un ácido se compone de un anión unido a suficientes iones H+ como para neutralizar totalmente o equilibrar la

carga del anión. Así pues, el ion SO42- requiere dos iones H+ para formar
H2SO4. El nombre del ácido se deriva del nombre de su anión.
Nombres y fórmulas de compuestos moleculares binariosLos procedimientos que se siguen para dar nombre a los compuestos moleculares binarios (formados por dos elementos) son similares a los que se emplean para nombrar compuestos iónicos:
a) Por lo general se escribe primero el nombre del elemento que está más a la derecha en la tabla periódica. Una excepción a esta regla es el caso de los compuestos que contienen oxígeno. El O2 se escribe siempre al último excepto cuando se combina con el flúor.
b) Si ambos elementos están en el mismo grupo de la tabla periódica, se nombra primero el que está más arriba.
c) Se añade la terminación -uro (-ido en el caso del oxígeno) al primer elemento y se inserta la partícula “de” entre los nombres de los dos elementos.
d) Se usan prefijos griegos para indicar el número de átomos de cada elemento. Nunca se usa el prefijo mono- con el segundo elemento. Si el prefijo termina en a u o y el nombre del anión comienza con vocal (como en óxido), por lo regular se omite la a u o.
Los ejemplos siguientes ilustran estas reglas:Cl2O monóxido de dicloro NF3 trifluoruro de nitrógenoN2O4 tetróxido de dinitrógeno P4S10 decasulfuro de tetrafósforo

PARTE EXPERIMENTAL
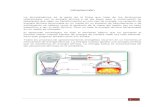
Experimento 1: Propiedades químicas de los metales: Sodio, Magnesio y Aluminio
1. Reacciones con el aguaa. Este experimento se realiza con ayuda del profesor.
A una cápsula de evaporación, agregar agua destilada y con la ayuda de una pinza seca, el profesor agrega un pedacito de sodio metálico.
Observar la reacción. Después de la reacción agregar 2 gotas de
fenolftaleína. Anotar los cambios observados durante todo el
experimento.
Datos y observaciones: La reacción es rápida y se observa la liberación de un gas
blanquecino.
Luego de agregar

fenolftaleína a la muestra ésta se torna de color rojo grosella inmediatamente en toda la solución, lo que indica el carácter fuertemente básico de la misma.
b. A un tubo de ensayo poner un pedazo de cinta de magnesio, agregar 2 ml de agua y agregar una gota de fenolftaleína. Observar que sucede. Anotar los cambios observados durante todo el
experimento.
Datos y observaciones: Se observa un burbujeo casi imperceptible y muy lento.
El cambio de color (luego de agregar fenolftaleína) es muy tenue (rosado), solo se nota alrededor de la cinta de magnesio, lo que indica el entorno básico alrededor de la misma. Esto indica que la reacción es muy lenta.

c. Introducir un pedazo de cinta de aluminio en un tubo de ensayo con agua. Observar que sucede. Coger el mismo pedazo de cinta de aluminio, secarlo
con papel filtro y limpiarlo. Introducirla a un tubo de ensayo con hidróxido de
sodio. Secar la cinta y limpiarla con papel filtro. Introducir la misma cinta a otro tubo de ensayo con
agua destilada. Observar que sucede. Agregar una gota de fenolftaleína. Anotar los cambios observados durante todo el
experimento.
Datos y observaciones: Ya que el aluminio es muy reactivo con el oxígeno, la
lámina está rodeada por una muy delgada capa de AlO3, la cual impide que el aluminio metálico reaccione con el agua.
Para eliminar esta capa de óxido, sumergimos la cinta en una disolución de NaOH(ac)
Como podemos ver en la reacción, el óxido de aluminio se convierte en hidróxido, el cual precipita y deja descubierto al aluminio metálico. Luego al introducir ésta cinta en agua, ésta recién reacciona.

Al agregar la fenolftaleína se observa que la muestra se torna rosada, lo cual demuestra el carácter básico de la misma.
2. Reacción con el oxigeno Quemar un pedazo de cinta de magnesio en el mechero y
observar lo que sucede.
Datos y observaciones: Ya que la reacción no se da por sí sola, necesita de calor
para iniciarse.
En la reacción se observa que el magnesio arde con un brillo enceguecedor (luz <> energía).
3. Reacción con un ácido A un tubo de ensayo colocar un trocito de zinc metálico
(granalla de zinc). Agregar 1 ml de ácido clorhídrico diluido. Anotar las observaciones de lo que sucede.

Datos y observaciones: Se observa inmediatamente el burbujeo
que se produce en la reacción (liberación de H2).
Como resultado de esta reacción se obtiene la respectiva sal (cloruro de zinc) en solución acuosa, la cual no precipita por ser soluble (iónica).
Conclusiones:
Los metales activos (grupo 1A) como el sodio son muy reactivos y al reaccionar con agua forman rápidamente sus respectivos hidróxidos, los cuales son muy solubles en agua y tienen un carácter fuertemente básico.
El aluminio a pesar de no ser del grupo 1A, es capaz de reaccionar rápidamente con el oxígeno del aire. Al reaccionar con el agua también forma su respectivo hidróxido, el cual no es soluble en el agua (precipitado) y tiene un carácter básico.
No todos los metales reaccionan de forma inmediata con el oxígeno como los metales activos (1A), sino que algunos necesitan de energía ( h) para iniciar el proceso de combustión.
Al reaccionar con un ácido, los metales forman rápidamente sus respectivas sales y liberan hidrógeno gaseoso.

Experimento 2: Propiedades químicas de no metales
1. Reacción con el agua En un tubo de ensayo colocar un poco de azufre y
adicionarle un poco de agua. Anotar observaciones de lo que sucede.
Datos y observaciones: No se da ninguna reacción, el azufre flota, lo que indica
que además de ser insoluble es menos denso que el agua.
2. Reacción con oxígeno (con ayuda del profesor, realizar en la campana extractora) En una cápsula de evaporación colocar un poco de azufe. Quemar azufre en el aire. Anotar observaciones de lo que sucede.
Datos y observaciones: Luego de la combustión se observa la liberación de un
gas.
3. Reacción con metales (con ayuda del profesor, realizar en la campana extractora) En una cápsula de evaporación mezclar Zn en polvo con
azufre en polvo (1:2). Tocar la mezcla con una bagueta caliente. Anotar las observaciones de lo que sucede.

Datos y observaciones: Se observa la formación de otra sustancia.
Conclusiones:
Los no metales no reaccionan con el agua y son insolubles en el mismo.
Reaccionan con el oxígeno por combustión, liberando energía.
Al combinarse con metales, forman sus respectivas sales.
EXPERIMENTO 3: Propiedades químicas de óxidos
1. Reacción con agua En una cápsula de evaporación colocar un
poco de óxido de calcio. Añadir 2 a 3 ml de agua destilada. Después de la reacción separar la solución
en dos tubos de ensayo.Datos y observaciones: Se observa la formación de una
sustancia blanquecina poco soluble en agua.

Al primer tubo adicionarle 1 gota de fenolftaleína.
Datos y observaciones: La solución se torna de un rojo grosella
(carácter fuertemente básico).
Al segundo tubo con la solución, hacerlo reaccionar (burbujear) con CO2.
Obtener el dióxido de carbono con ayuda del profesor (hacer reaccionar 3 g de carbonato de sodio -Na2(CO3)- con 6 ml de HCl 6N)
Datos y observaciones: Luego del burbujeo se observa la formación de una
sustancia blanquecina, poco soluble en agua (precipitado menudo).

2. Reacción con ácido En un tubo de prueba colocar 0,5 g de óxido de calcio. Añadir 5 ml de HCl diluido. Anotar las observaciones de lo que sucede.
Datos y observaciones: En la reacción se forma el cloruro respectivo
Conclusiones: Los óxidos de los metales de los grupos 1A y 2A, son
capaces de reaccionar con el agua para formar sus respectivos hidróxidos.
Los óxidos de los metales de los grupos 1A y 2A, tienen carácter básico, por lo que se neutralizan con ácidos fuertes como el HCl.
EXPERIMENTO 4: reacción entre sales
En un tubo de prueba colocar 1 ml de nitrato de plata.
Añadir 1 ml de cromato de potasio. Anotar las observaciones de los que
sucede.
Datos y observaciones: Se observa una reacción de doble sustitución.

Conclusiones generales del informe
Luego de realizar los distintos experimentos podemos concluir:
No todos los metales tienen el mismo comportamiento frente al agua, oxígeno y los ácidos, depende de sus propiedades químicas como la reactividad.
Los óxidos metálicos tienen carácter básico, por lo que se neutralizan con ácidos fuertes como el HCl.
Los no metales reaccionan con el oxígeno mediante la combustión.
Las reacciones que se dan entre sales, suelen ser dobles sustituciones.
Aplicaciones a la carrera
En metalurgia, los metales no se encuentran solos; se encuentran combinados (principalmente en las minas peruanas en forma de sulfuros) y rodeados por diferentes minerales. Al saber las propiedades químicas de los metales, podemos plantear procesos para separarlos y obtenerlos sin necesidad de causar grandes daños a nuestro medioambiente.

Recomendaciones
Al realizar las diversas reacciones, en varias se liberan gases que pueden ser altamente tóxicos; es preferible realizarlas en la campana extractora para evitar lesiones.
Los hidróxidos de metales activos no deben tener contacto directo con la piel, de suceder lavarse inmediatamente con abundante agua; para evitar quemaduras.
Es necesario el no contaminar las muestras para mejores resultados.
Cuestionario
1. ESCRIBIR LAS ECUACIONES QUIMICAS DE TODOS LOS EXPERIMENTOSTodas y cada una de las ecuaciones respectivas de cada experimento se encuentran escritas luego de los procedimientos de los mismos.
2. ESCRIBIR LOS NOMBRES CORRECTOS DE TODOS LOS COMPUESTOS QUIMICOS QUE INTERVIENEN EN LA PRACTICA
Experimento 1: Hidróxido de sodio NaOH Hidróxido de magnesio Mg(OH)2

Óxido de aluminio Al2O3
Hidróxido de aluminio Al(OH)3
Óxido de sodio Na2O Óxido de magnesio MgO Ácido clorhídrico HCl(ac)
Cloruro de zinc ZnCl2
Óxido de azufre (II) SO Sulfuro de zinc ZnS Óxido de calcio CaO Hidróxido de calcio Ca(OH)2
Carbonato de sodio Na2(CO3) Cloruro de sodio NaCl Dióxido de carbono CO2
Carbonato de calcio CaCO3
Cloruro de calcio CaCl2
Nitrato de plata AgNO3
Cromato de potasio K2CrO4
Nitrato de potasio KNO3
Cromato de plata Ag2CrO4
3. MENCIONE DOS PROPIEDADES COMUNES DE LOS COMPUESTOS FORMADOS
Na2Oy MgO (óxidos básicos) cuando reaccionan con agua forman Na(OH) y Mg(OH) (hidróxidos) que son bases

fuertes, son jabonosas, posen sabor amargo, neutralizan a los ácidos, etc.
NaCl y CaCl2 (sales neutras) son compuestos iónicos muy solubles en agua y son electrolitos fuertes.
4. INDIQUE PARA QUE SE USA LOS SIGUIENTES COMPUESTOS
A. NaNO3
• Debido a su contenido en nitrógeno se utiliza como fertilizante.
• Fundido en mezcla con carbonato sódico, en la obtención del cromo de sus minerales por oxidación de este metal a cromato. (CrO4
2-)• Como conservante en la industria alimenticia (E251) y
en la mezcla de sales empleada para tratar la carne en su conservación.
• Como aditivo para el cemento.• Es uno de los ingredientes mayoritarios de ciertos tipos
de pólvora negra.• Debido a que al quemarse genera oxígeno, ha sido
empleado en varias ocasiones a lo largo de la historia para conseguir un fuego que ardiese bajo el agua, como es el caso del fuego griego.
B. MgSO4(sal de Epsom)
Uso agrario, en agricultura y jardinería el sulfato de magnesio se emplea como corrector de la deficiencia de magnesio en el suelo (el magnesio es un elemento

esencial en el proceso de la molécula de clorofila). Es común su aplicación en el cultivo de plantas en huerto o en maceta cuando sus suelos carecen de suficiente magnesio, por ejemplo para patatas, rosas, y tomates. La ventaja del sulfato magnésico sobre otros aditivos de magnesio para el suelo, es su alta solubilidad.
Uso médico, artículo principal: Hipomagnesemia, el magnesio ha mostrado tener efectos benéficos al producir relajación del músculo liso y disminución de la inflamación. Por lo tanto se usa local o tópico para tratamiento de procesos inflamatorios por traumas o para la uña encarnada. La sales de Epsom también están disponibles en forma de gel para aplicación tópica sobre heridas y áreas doloridas. En administración intravenosa se emplea frecuentemente para reducir la intensidad de los calambres.
C. Al2O3
Es producido por Proceso de Bayer de bauxita. Su uso más significativo está en la producción de aluminio metálico, aunque también se utiliza como abrasivo debido a su dureza y como a refractario material debido a su punto de fusión elevado.
D.BaSO4
Es un mineral muy común. Aparece frecuentemente como envolviendo los filones de minerales metálicos. Es

así una de las gangas filonianas junto con la calcita y el cuarzo, que aparecen junto a ella
Es la fuente principal de bario. Debido a su densidad, se usa en los barros (lodos) de perforación de pozos.
Se lo utiliza en la producción de agua oxigenada, en la fabricación pigmentos blancos y, como carga mineral, en pinturas y en la industria del caucho.
Se lo emplea especialmente en la producción del litopón, una combinación de sulfuros y sulfatos usados para recubrimientos.
Se lo usa también en la industria de los frenos, del vidrio y como recubrimiento en las salas de rayos X.
5. INDIQUE QUE METAL TIENE MAS POSIBILIDAD DE ENCONTRASE EN ESTADO LIBRE EN LA NATURALEZA
MAGNESIO: Estado natural, se halla en la naturaleza en una proporción de 1,93% de masa. Sus minerales más comunes son: la magnesia, la magnesita y la dolomita. También se encuentra en las plantas verdes y en cantidades considerables en el agua del mar.
6. INDIQUE QUE METAL TIENE MENOS POSIBILIDAD DE ENCONTRARSE NO CONVINADO CON OTROS ELEMENTOS
ALUMINIO: Estado natural, el aluminio no se encuentra libre en la naturaleza, pero sus combinaciones son numerosas y ampliamente distribuidas. Es el tercero en abundancia después del oxígeno y el silicio.

7. ¿QUE METODO CONOCE PARA OBTENER METALES SIN IMPUREZAS?
Flotación: Proceso metalúrgico que permite la separación de las especies valiosas contenidas en un mineral, del material estéril. Para lograr una buena separación, es necesario que estas especies valiosas sean liberadas del material estéril. Esto se logra moliendo el mineral en circuitos de molienda. La separación se realiza en agua formándose una pulpa y en donde las partículas sólidas se mantienen en suspensión por medio de unos agitadores especialmente diseñados para este caso.A la pulpa se agrega una serie de reactivos químicos especiales que causan una condición de hidrofobicidad sobre las partículas valiosas de tal manera que, al introducir aire al sistema, se produce un conjunto de burbujas sobre las cuales se adhieren estas partículas. Las burbujas, a medida que van ascendiendo, se van enriqueciendo de estas partículas hasta que se alcanza la superficie y en donde son posteriormente retiradas. Mientras tanto, las partículas de material estéril no han sido afectadas por los reactivos químicos y permanecerán suspendidas dentro de la pulpa.La flotación se realiza generalmente para la recuperación de metales que se encuentran en el mineral como sulfuros, aunque existen casos donde se usa para la recuperación de especies oxidadas o de no-metálicos.

Flotación BulkRecuperación de todas las especies valiosas (oro, plomo, plata, zinc, cobre, etc.) en un solo producto llamado Concentrado Bulk.
Flotación diferencialEs el proceso por el que dos o más especies valiosas son recuperadas en concentrados separados. En el caso de mineral de Plomo-Zinc, el plomo se flota en un concentrado de plomo inhibiendo la flotación de Zinc. Después de que la flotación del plomo ha terminado, el zinc es activado y recuperado en un concentrado separado.
Fundición: Proceso piro-metalúrgico para eliminación de las impurezas con las que el metal puede estar químicamente combinado o físicamente mezclado.
Lixiviación: En la cual el compuesto que contiene el metal deseado se disuelve de modo selectivo. Si el compuesto es soluble en agua, el agua misma es un agente de lixiviación idóneo. Es más común que el agente sea una disolución acuosa, de un ácido, base o sal. El proceso de disolución suele implicar la formación de un ion complejo.El oro metálico suele hallarse relativamente puro en la naturaleza. A medida que los depósitos concentrados de oro elemental se han agotado, las fuentes de menor calidad han adquirido mayor importancia. El oro de menas de baja calidad se concentra colocando la mena triturada sobre grandes planchas de concreto, donde se rocía con una

disolución de NaCN. En presencia de CN- y aire, el oro se oxida y forma el ion estable Au(CN)2-, que es soluble en agua:
4Au(s)+ 8CN-(ac)+O2(g)+ 2H2O(l)→ 4Au(CN)2-
(ac) + 4OH-(ac)
Una vez que se ha lixiviado selectivamente de una mena, el ion metálico se precipita de la disolución en forma de metal libre o de un compuesto iónico insoluble.El oro, por ejemplo, se obtiene de su complejo de cianuro por reducción con polvo de zinc:
2Au(CN)2-(ac)+ Zn(s)→ Zn(CN)4
2-(ac)+ 2Au(s)
Bibliografía
Silberberg. Química “La naturaleza molecular del cambio y la materia” segunda edición, editorial: Mc Graw-Hill.
Brown, Lemay, Bursten. Química “La ciencia central” novena edición, editorial Pearson.
Raymond Chang. “Química General” séptima edición, editorial: Mc Graw-Hill.