Gluconeogénesis o síntesis de glucosa
-
Upload
barbara-soto-davila -
Category
Documents
-
view
3.792 -
download
2
Transcript of Gluconeogénesis o síntesis de glucosa
Laura del Olmo
1
Tema 5: GLUCONEOGÉNESIS o síntesis de glucosa
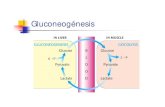
Ruta metabólica de síntesis de glucosa a partir de metabolitos (precursores) que no son hidratos de carbono (por ej.
lípidos glicerol glucosa). Es decir, síntesis de glucosa no a partir de glucógeno.
Lo normal es extraer la glucosa del glucógeno pero esto no es gluconeogénesis.
¿Cuándo es necesaria?
El organismo humano consume unos 160 gramos de glucosa al día; de estos, el cerebro se lleva 120, de manera que
el SNC en general (cerebro), los eritrocitos, la médula del riñón, el intestino… dependen fundamentalmente de la
glucosa para “vivir”.
¿Cuánta glucosa hay en el organismo?
Del glucógeno hepático y del MS esquelético se puede sacar unos 190-200 g de glucosa; y de los fluidos corporales
15-20 g. Es decir, que con la glucosa que tenemos disuelta en fluidos y con la del glucógeno tenemos para poco más
de un día, de manera que durante un ayuno prolongado, un ejercicio intenso o en situaciones que consumamos más
glucosa de lo normal habrá que sintetizar glucosa.
Homeostasis glucémica: [G] = 90 mg/100 ml hay que mantenerla constante, por eso hay que sintetizar glucosa; no
nos vale la disuelta o la del glucógeno.
¿Quién efectúa la síntesis de glucosa/gluconeogénesis?
Esta casi limitada exclusivamente al hígado y a la corteza renal del riñón.
Hígado 90%
Corteza renal 10%. La aportación de glucosa por la corteza renal cobra vital importancia en ayunos
prolongados o cuando el hígado está dañado.
En condiciones normales es el hígado el que sintetiza normalmente la glucosa.
¿A partir de quién sintetizan glucosa?
Pirúvico, láctico o intermediarios del Ciclo de Krebs (TCA).
Aminoácidos: casi todos de los 20 pueden dar a glucosa; los más importantes son: alanina (Ala) y glutamina
(gln)
¡Excepciones de aá que no dan glucosa!: *lisina y leucina*
No obstante, la síntesis de glucosa a partir de aá no es deseable porque no almacenamos proteínas.
Glicerol. Su degradación es más deseable en ayunos prolongados que la de los aá, ya que su almacén es
amplio.
Gasto para la obtención de glucosa según orden de actuación: (1) glucógeno, (2) grasa y (3) proteínas.
Laura del Olmo
2
A partir de Acetil-CoA no podemos formar glucosa.
Gluconeogénesis vía *PIRUVATO* glucosa (no es el sustrato más importante de la
gluconeogénesis)
- Síntesis de glucosa a partir de piruvato.
- La mayor parte se produce en el *citosol*, pero vamos a necesitar una pequeña aportación/colaboración de
la mitocondria.
En principio la gluconeogénesis será igual que la glucólisis en todas aquellas reacciones reversibles, e incluso
estarán catalizadas por las mismas enzimas.
Pero en las 3 etapas/reacciones irreversibles de la glucólisis, la gluconeogénesis tendrá enzimas diferentes:
1) 1ª reacción irreversible de la glucólisis enzima hexoquinasa (HQ)
2) 2ª reacción irreversible de la glucólisis enzima fosfofructoquinasa-1 (PFK-1)
3) 3ª reacción irreversible de la glucólisis enzima piruvatoquinasa (PIR K)
Para estas 3 reacciones la gluconeogénesis “usará” distintas enzimas.
Reacciones.
1ª reacción irreversible: Pir PEP
Enzima en la glucólisis: PIR K
Enzima en la gluconeogénesis: *FOSFOENOLFOSFATO CARBOXIQUINASA* (PEP CARBOXI-K)
1) 1ª reacción de la gluneogénesis y también una reacción anaplerótica: Pir OAA (mitocondria) -
¿irreversible? (creo que sí)
Pirúvico en el citosol, atraviesa la Mb mitocondrial con un transportador (por ser polar), y se transforma en
oxalacético (OAA).
Carboxilación (incorporación de CO2)
Gasto/hidrólisis de 1 ATP ADP + Pi (biotina)
Enzima: *PIRUVATOCARBOXILASA*
2) Necesitamos un artefacto para sacar OAA de la mitocondria, para lo que el OAA se transforma en malato
(porque éste sí podrá atravesar la Mb mitocondrial porque tiene un transportador). El fin de este paso es
sacar el OAA fuera: OAA Malato (mitocondria) - reversible
Oxidación del NADH + H+ NAD+
Enzima: Malato deshidrogenasa mitocondrial
La mitocondria solo la necesitamos para ese 1er paso, pues el malato sale ya a continuación al citosol.
Laura del Olmo
3
3) Malato OAA (citosol) - reversible
Reducción del NAD+ NADH + H+
Enzima: Malato deshidrogenasa citosólica
4) OAA PEP (compuesto rico en energía) – “irreversible”
Descarboxilación con liberación de CO2
Se necesita energía para formarlo: GTP GDP
Enzima: fosfoenolfosfato carboxilasa
Aunque esta última reacción es reversible, realmente en la célula (citosol) es prácticamente irreversible, ya
que cuando el motivo es la gluconeogénesis, como lo gastamos, la reacción se desplaza hacia ese sentido, así
irreversible.
Una vez formado el PEP, el resto de reacciones (hacia arriba) serán iguales que en la glucólisis pero en sentido
contrario.
2ª reacción irreversible: F-1,6-BP F6P: hidrólisis de la fructosa-1,6-bisfosfato, que libera un
fosfato inorgánico (Pi) - reacción mucho más simple que en la glucólisis.
Enzima en la glucólisis: fosfofructoquinasa-1 (PFK-1)
Enzima en la gluconeogénesis: *FRUCTOSA-1,6-BISFOSFATASA* (F-1,6-BP)
3ª y última reacción irreversible: G6P + H2O (no rico energéticamente) G: también arrancamos el
fosfato.
Enzima en la glucólisis: hexoquinasa
Enzima en la gluconeogénesis: *GLUCOSA-6-FOSFATASA*
En humano es exclusiva de hígado y corteza renal , lo que quiere decir que el resto de los tejidos apenas hacen
gluconeogénesis, y aunque hicieran “un poquito” llegarán hasta aquí, hasta la G6P, porque no tienen esa enzima (la
glucosa-6-fosfatasa exclusiva de hígado y corteza renal), por lo que no pueden liberar glucosa a sangre.
Solo hígado y corteza renal pueden llegar hasta glucosa y liberarla al plasma, gracias a la enzima glucosa-6-
fosfatasa; el resto de tejidos no, lo utilizarán para consumo propio ya que no pueden liberar glucosa a
sangre.
Balance energético de la síntesis de glucosa o Gluconeogénesis
- 1er paso: consume ATP, 2 por cada piruvato - 2 ATP
- 2º paso: vuelvo a gastar GTP = ATP - 2 GTP ó ATP
- Paso de 1,3BPG G3P (misma reacción glucolisis pero al revés): gastaré más ATP - 2 ATP
- Consumo 2 NADH + 2H+, que pueden generar hasta 6 ATP, 3 cada uno) - 6 ATP
Final: puede gastar hasta - 12 ATP
Laura del Olmo
4
Una vía catabólica gasta menos energía de lo que gasta una vía anabólica, es decir, siempre es más costosa
la parte anabólica, que lo que produzco.
Regulación de la Gluconeogénesis
Por lógica la regulación será justo al revés que la de la glucólisis, es decir, cuando una célula necesita energía
produce glucólisis y se inhibe la gluconeogénesis.
En las situaciones en las que se potencia la glucólisis se inhibe la gluconeogénesis y viceversa. Estarán
perfectamente coordinadas; si una está muy activa la otra casi no se produce.
Repaso regulación glucólisis
- Regulación de la Hexoquinasa (HQ): era inhibida alostéricamente por la glucosa-6-fosfato (-)
- Regulación de la Glucoquinasa (del tipo HQ IV pero exclusiva de hígado): era aumentada con la insulina (+)
- Regulación de la Fosfofructoquinasa-1 (PFK-1):
Inhibidores (-) alostéricos: ATP (cuando hay energía no glucólisis), citrato, ácidos grasos
Activadores (+) alostéricos: AMP, ADP, fructosa-2,6-bisfosfato (F-2,6-BP)
Control hormonal sobre esa enzima:
o Efecto global del glucagón (-) sobre esta enzima: aumenta los niveles de glucosa, por lo que
inhibe la glucólisis.
o Efecto global de la insulina (+): disminuye los niveles de G por lo que activa la glucólisis.
- Regulación de la Piruvato quinasa (PIR K):
(+): PEP, fructosa-1,6-BP (los más importantes); también AMP
(-): ATP, piruvato; también alanina
Efecto de glucagón e insulina: igual que en la anterior (PFK-1):
o Glucagón = (-)
o Insulina = (+)
Regulación Gluconeogénesis
PIRUVATO CARBOXILACA (PIR-CARBOXILASA) – regulada en actividad (regulación rápida)
- Activadores (+) alostéricos: Acetil-CoA
Cuando aumenta el Acetil-CoA se activa la piruvato carboxilasa, y por tanto aumentan los niveles de OAA
(oxalacético), que también es un metabolito del Ciclo de Krebs; ahora estamos usando al OAA como precursor de
glucosa para gluconeogénesis.
¿Cómo diferencia la célula entre el OAA metabolito del Ciclo de Krebs o el OAA precursor de la glucosa en
la gluconeogénesis? Lo decide la energía: si hay poca energía habrá que producirla en el Ciclo de Krebs; si en
cambio hay mucha energía, habrá que producir gluconeogénesis.
Laura del Olmo
5
Si mucho ATP Gluconeogénesis Si poco ATP Ciclo de Krebs
FOSFOENOLFOSFATO CARBOXIQUINASA (PEP CARBOXI-K) – regulada en cantidad (regulación lenta
o a largo plazo)
Hasta llegar aquí el resto de enzimas venían reguladas en la actividad (regulación rápida o a corto plazo).
Recordemos que la regulación de las enzimas se produce a 2 niveles: (1) en cantidad (hormonas) y (2) en
actividad (metabolitos, aunque también hormonas, por ej. en la PFK-1).
- Aumenta (+) con el ayuno, ejercicio intenso o situación patológica equivalente (diabetes: forman mucha
glucosa aun no necesitándola que las células no pueden captar)
Estamos secretando glucagón.
- Disminuye (-) tras una comida (sobre todo si ésta ha sido rica en HC)
Estamos secretamos insulina.
Esta enzima a través del glucagón y la insulina, aunque son hormonas que no entran en la célula, tiene
efecto de aumentar el nivel de determinadas hormonas.
FRUCTOSA-1,6-BISFOSFATASA (F-1,6-BP) – regulada en actividad o a corto plazo
Sus activadores (+) e inhibidores (-) serán los contrarios de la Glucólisis.
- Activadores (+): sobre todo ATP y citrato; también AG (ácidos grasos)
- Inhibidores (-): AMP, ADP y fructosa-2,6-bisfosfato
- Efecto final de las hormonas (el contrario de la glucólisis):
Glucagón = (+) – activa gluconeogénesis
Insulina = (-) – inhibe gluconeogénesis
¿Cuándo producimos glucógeno?
- Desde el punto de vista energético: cuando hay ATP suficiente
- Desde el punto de vista de metabolitos: cuando hay suficientes metabolitos
Cuando tenemos energía o sustratos oxidables suficientes, la gluconeogénesis se potencia.
GLUCOSA-6-FOSFATASA (G-6-P) – regulada en cantidad de sustrato
No es una regulación alostérica ni de otro tipo.
- Aumenta (+): con un incremento de glucosa-6-fosfato (potencia el funcionamiento de la enzima)
Laura del Olmo
6
Cuando hay mucha G-6-P la desvía a glucosa en la gluconeogénesis (defosforila una parte). La cantidad de G-
6-P es lo que hace que la reacción vaya en un sentido u otro.
CICLOS DE SUSTRATO (“Ciclos fúsiles o inútiles”)
A estas 3 reacciones irreversibles presente en glucólisis y gluconeogénesis se les llama ciclos de sustrato. Son
aquellas reacciones de 2 rutas metabólicas opuestas (degradación/síntesis) que vienen catalizadas por enzimas
diferentes.
2 rutas: (1) degradativa y (2) síntesis anabólica.
El Ciclo más importante será el central: fructosa-6-fosfato fructosa-1,6-bisfosfato.
Lo lógico es pensar que mientras ocurre la Glucólisis nada de F-6-P se produce. Sin embargo, lo más
llamativo es que cuando la Glucólisis se está produciendo a tope, hay un poquito de Gluconeogénesis, y esto
implica que hay gasto de energía: F6P + ATP F-1,6-BP.
Desventaja (por el gasto “inútil” de ATP) y Ventaja (energía no desperdiciada si no aprovechada para
aumentar la tª corporal) de los Ciclos de Sustrato
Los llamaron en un principio Ciclos “fútiles” o “inútiles” porque gastan ATP “a lo tonto”, por lo que se pensaba que
era un defecto metabólico.
Pero tienen una ventaja metabólica tremenda: hay animales que esa energía que parece que se desperdicia la
utilizan como calor corporal, calor que necesitan de manera obligada para poder vivir (ej. los abejorros necesitan
una tª en su cuerpo determinada; también en recién nacidos para mantener su tª corporal; en adultos sensibilidad a
los reguladores).
Por tanto, ese energía no se desperdicia, tiene algún fin. En el ser humano su mayor finalidad será mantener la tª
corporal en el recién nacido e incrementar la sensibilidad a todos esos reguladores en el adulto (la sensibilidad a
los reguladores es mucha mayor cuando se producen los Ciclos de Sustrato).
Ventajas de los Ciclos de Sustrato (glucólisis/gluconeogénesis a la vez)
En el organismo humano también *aumenta la sensibilidad a los reguladores* (sobre todo alostéricos)
principal ventaja.
Al perder esa energía lo hace en forma de calor, de manera que permite mantener una tª corporal
adecuada a los recién nacidos.
¿Cómo aumenta la sensibilidad a los reguladores?
Nos fijamos en uno de los 3 ciclos glucólisis/gluconeogénesis, el central y más importante, el que se da entre
F6P F1,6BP
Laura del Olmo
7
- Vamos a suponer que la transformación se produce directamente (y no en ciclo), y que 10 moléculas de F6P
se transforman en 10 moléculas de F1,6BP.
- Ahora imaginamos el ciclo y exageramos los valores, suponiendo que se producen 100 moléculas de F1,6BP
por 90 de F6P (balance neto igual: 10 F6P – 10 F1,6BP).
- Ahora añado un regulador que aumenta la velocidad en un 20%, con lo que pasamos de 10 moléculas a 12,
y suponiendo que en el sentido contrario la velocidad disminuye igualmente un 20%, con los valores
exagerados obtengo que:
o Ahora (con el regulador) se estarán formando 120 moléculas de F1,6BP por 72 de F6P
Balance 120 – 72 = 48 moléculas de F6P 48 moléculas de F1,6BP
Velocidad sin efector = 10
Velocidad con efector = 48
Como podemos observar ese efector en vez de aumentar la velocidad un 20% la aumenta un 380%, con lo
que estamos aumentando mucho la sensibilidad a los efectores; es decir, con la misma función tienen un
efecto enorme (de velocidad de 10 a 48).
Conclusión: aparentemente gastamos energía pero a la vez estamos aumentando la sensibilidad a los
efectores, es decir, se aumenta la capacidad de regulación, por lo que los Ciclos de Sustrato no son inútiles
si no muy beneficiosos para el organismo.
Gluconeogénesis vía *ÁCIDO LÁCTICO* glucosa (ácido láctico como sustrato más importante de
la gluconeogénesis o precursor de glucosa): CICLO DE CORI
El ácido láctico es el sustrato más importante de la gluconeogénesis y se genera en la glucólisis anaerobia en
aquellos tejidos que disponen de poco oxígeno (músculo esquelético haciendo ejercicio, médula renal, eritrocitos sin
mitocondrias…), de manera que es un producto sobre todo de MS esquelético en ejercicio y eritrocitos.
Músculo haciendo ejercicio (tendrá que efectuar obligadamente la glucólisis anaerobia, ya que dispondrá de
poco oxígeno) utiliza su propio glucógeno:
1. Dentro del músculo: glucógeno G6P Pir (Poder reductor: oxidación de NADH + H+ a NAD+) Lac
- Con el láctico no puede hacer nada (no se puede reconvertir a Pir), así que lo libera a sangre.
2. Plasma: Lac
- Lo recoge el hígado, que tiene mucho NAD+, así que hace la reacción contraria.
3. Hígado: Lac (reducción de NAD+ a NADH + H+) Pir G6P (también podrá degradador su propio
glucógeno) G
4. Plasma: G
5. Dentro del músculo: G G6P
Laura del Olmo
8
La gluconeogénesis vía ácido láctico (o con el ácido láctico como sustrato o precursor de glucosa) es un ciclo
muy activo y se llama CICLO DE CORI (circulación cíclica de la glucosa y el lactato entre el músculo y el
hígado), siendo fundamental para recuperar el músculo tras el ejercicio. Un músculo no entrenado
enseguida gasta su propio glucógeno
¿Por qué la transformación se produce en ese sentido (MS plasma hígado plasma MS) y
no en el contrario?
El sentido de la vía está dirigido por los CoE de poder reductor NAD+ y NADH + H+, ya que mientras que el músculo
tiene NADH, el hígado tiene NAD+, por eso se produce en ese sentido.
El sentido de la vía depende de:
- Los niveles de sustrato (sobre todo de NAD+, NADH + H+ y láctico)
- De las enzimas que catalizan la vía
ENZIMA LACTATO DESHIDROGENASA (LDH) – 5 Isoenzimas
Las isoenzimas difieren en la secuencia de aminoácidos pero catalizan la misma reacción química, suelen mostrar
diferentes parámetros cinéticos (diferente afinidad por el sustrato) o propiedades de regulación diferentes, y
permiten el ajuste del metabolismo para satisfacer las necesidades particulares de un determinado TJ.
La vía de la gluconeogénesis a partir de ácido láctico viene catalizada por la enzima LACTATO DESHIDROGENASA
(LDH): Pir + NADH + H+ *LDH* Lac + NAD+
Es una enzima que en humanos se encuentra en forma de 5 isoenzimas LDH distintas, todas ellas con 4 cadenas
proteicas:
1. LDH 1: cadenas H4 característica de corazón (MS cardíaco): Lac Pir
2. LDH 5: M4 característica de MS esquelético e hígado: Pir Lac
El resto serán todas las combinaciones posibles y estarán distribuidas por las distintos TJs:
3. LDH 2 H3M 4. LDH 3 H2M2 5. LDH 4 HM3
- En aquellos TJs en los que predomine la isoenzima LDH 1 (H4) corazón, tendrán una enzima con gran
afinidad por el ácido láctico, por lo que efectúan esencialmente la transformación: LAC PIR
- Y al revés, en aquellos TJs en los que predomine la isoenzima LDH 5 (M4) MS esquelético, tendrán una
enzima con gran afinidad por el ácido pirúvico, por lo que efectúan esencialmente la transformación: PIR
LAC
Dependiendo de la isoenzima y del nivel del oxígeno (NAD+/NADH), efectuarán una transformación u otra,
es decir, las 5 isoenzimas catalizan la misma reacción, pero unas tienen más afinidad por LAC PIR y otras
por PIR LAC; por tanto las transformaciones se efectúan en un sentido u en otro atendiendo a la
Laura del Olmo
9
isoenzima y a los niveles de metabolitos. Por ej. el músculo en ejercicio tiene NADH (y no NAD) y la
isoenzima es la M4, por tanto realizará la transformación PIR LAC.
Hígado: tiene de todas las isoenzimas pero mayoritariamente LDH 5 (M4).
- ¿Quién decide? El nivel de NAD+ y el nivel de láctico. Podría efectuar cualquier transformación pero
como tiene mucho NAD+, hacia arriba.
ISOENZIMAS: GRAN UTILIDAD EN CLÍNICA
Al ser características de ciertos TJs (y por tanto encontrarse en mayor medida en ellos) nos será posible detectar
daño simplemente viendo en un análisis si sus niveles varían.
- Por ej., si hay daño en el corazón las enzimas LDH 1 H4 salen a plasma, así que si en plasma vemos alto nivel
de LDH 1, esto nos indica que hay daño en corazón. Importante para detectar infartos de miocardio, y así ir
viendo la evolución si baja este nivel.
- A su vez los niveles de LDH 5 nos sirven para detectar daño hepático.
Son muy útiles aquellas enzimas que están en alta proporción en un único tejido, es decir, aquellas enzimas
que abundan más en unos tejidos que en otros, o que son específicas de un único TJ, nos serán de gran
utilidad a la hora de detectar daño en un órgano.
Cuando el sustrato de la gluconeogénesis es el ÁCIDO LÁCTICO se necesita otro
artefacto/lanzadera para sacar al OA de la mitocondria ASPÁRTICO:
Citosol: Lac Pir Mitocondria OAA *ASPÁRTICO* (Asp)
Como el OA no tiene transportador necesitará crear un artefacto que le permita salir de la mitocondria; este
artefacto es una lanzadera.
Para ello el OA se transforma en aspártico para lo que necesita un grupo amino que le aporta el glutámico (Glu);
este glutámico a su vez, al cederle el grupo amino al aspártico se transforma en α-cetoglutárico. Así el aspártico (que
tiene transportador) sale de la mitocondria ya sin problemas.
Además el α-cetoglutárico también puede salir, transformándose de nuevo en glutámico y cerrando así la lanzadera.
- El resto de sustratos sale como málico.
Recordemos que cuando era el ÁCIDO PIRÚVICO el que actuaba como sustrato de la gluconeogénesis, el
OAA salía de la mitocondria como málico.
PIR: OAA *málico*
LAC: OAA *aspártico*
Laura del Olmo
10
Recordatorio precursores de glucosa (ya hemos hablado de pirúvico y láctico):
1. Procedentes de hidratos de carbono: Pirúvico, láctico o intermediarios del Ciclo de Krebs (TCA).
- Los intermediarios del Ciclo de Krebs los saltamos porque llegan a OA y partir de ahí a G (es evidente).
2. Procedentes de los aminoácidos más importantes: *alanina* (Ala) y *glutamina* (Gln)
o Todos pueden dar glucosa excepto lisina (Lis) y leucina (Leu).
3. Procedentes de lípidos: glicerol.
Gluconeogénesis vía *ALANINA (Ala)* glucosa (alanina como precursor de glucosa o sustrato de
gluconeogénesis): CICLO GLUCOSA-ALANINA
La libera fundamentalmente el MS esquelético en ejercicio, y una parte de los productos en ejercicio son láctico y
*alanina*.
Cuando el músculo está haciendo ejercicio degrada su glucógeno a glucosa PIR, pero puede llegar un momento
que comience a degradar proteínas que liberan aminoácidos, y estos aá liberan el grupo amino (-NH2); entonces ese
pirúvico con ese grupo amino forma la alanina.
La libera a plasma, donde la recoge también el hígado; en el hígado se reconvierte en pirúvico, liberando el grupo
amino de los aminoácidos, y este Pir lo reconvierte en glucosa, que sale a plasma de nuevo, para que lo recoja el
músculo y lo pueda seguir utilizando.
Este ciclo recibe el nombre de Ciclo Glucosa-Alanina, y cuantitativamente es menos activo y menos importante que
el Ciclo de Cori (glucosa-láctico), pero cualitativamente tiene una doble función:
1. La única función (aunque no menos importante) del ciclo de Cori es recoger el desecho (láctico) y convertirlo
en algo útil, glucosa. Esta función también será llevada a cabo por el Ciclo Glucosa-Alanina, que reciclará la
alanina a glucosa.
2. Función exclusiva del Ciclo Glucosa-Alanina: la alanina lleva un grupo amino (-NH2) que se libera como ión
amonio (NH4+). Este ión no se puede liberar a plasma porque es muy tóxico, así que este ciclo sirve para
reconducir al hígado el grupo amino y que no se libere como ión amonio NH4+, sino en forma de urea (que
es atóxica). Así el hígado extrae ese grupo amino, y lo transforma en urea, que a través del riñón se elimina
por la orina (también atóxica).
El Ciclo Glucosa-Alanina, aunque cuantitativamente es menos importante que el Ciclo de Cori,
cualitativamente es fundamental porque es el único que puede detoxificar al organismo de ión amonio, es
decir, el único que hace Ciclo de la Urea.
o Este Ciclo de la Urea estará acentuado en diabéticos (por eso eliminan mucha orina).
Gluconeogénesis vía *GLUTAMINA (Gln)* glucosa (glutamina como precursor de glucosa o
sustrato de gluconeogénesis)
La glutamina es liberada por muchos TJs (como el músculo y otros), como forma de enviar el grupo amino al hígado,
o en este caso también, una parte importante al riñón.
Laura del Olmo
11
La captan en este caso tanto el hígado como la corteza renal (recordemos que la corteza renal hace un 10% de
gluconeogénesis – la mayoría la realiza el hígado - , y ésta poca que hace suele ser con glutamina).
Pasa a la mitocondria con un transportador. Allí libera su grupo amida, y se transforma en glutámico; éste libera su
grupo amino y se transforma en α-cetoglutárico, que a través del ciclo de los ácidos tricarboxílicos o de Krebs, se
transforma en OA, de manera que es un metabolito normal del ciclo que sigue la ruta hasta el OA, que a través de
esa lanzadera (malato) sale de la mitocondria. El OA siguiendo la gluconeogénesis sintetiza glucosa que es enviada a
sangre y que recogen en general todos los TJs.
De los precursores de glucosa o sustratos de gluconeogénesis que proceden de aminoácidos,
cuantitativamente es más importante la alanina.
Gluconeogénesis vía *GLICEROL* glucosa (glicerol como precursor de glucosa o sustrato de
gluconeogénesis)
El 90 % de los lípidos compuestos son triglicéridos o vulgarmente la grasa. Estos se desdoblan en AG y glicerol.
El TJ adiposo libera glicerol, que lo capta también mayoritariamente el hígado; lo fosforila directamente en el citosol
con ATP.
Enzima: GLICEROL-QUINASA
- Transforma G2P oxidándolo con NAD+,
Enzima: GLICEROL-3-FOSFATO DESHIDROGENASA
- Dando lugar a DHAP (dihidroxiacetona-fosfato) x2: (1) una queda como 1DHAP y (2) la otra se
transforma en 1G3P (gliceraldehído-fosfato) para poder continuar la gluconeogénesis.
Se unen las 2 (1DHAP – 1G3P), y por gluconeogénesis siguen hasta sintetizar la glucosa, que va a plasma para que la
capten los tejidos que la necesitan.
¿Cuándo degradamos grasa? En ayuno o ejercicio.
Esto NO es un ciclo porque el TJ adiposo no recoge esa glucosa.
Conclusión: cualquier cosa la podemos transformar en glucosa, pero no en Acetil-CoA. El Acetil-CoA es el único
intermediario que no podemos transformar en glucosa.
Procedente de hidratos de carbono: ÁCIDO PIRÚVICO y *ÁCIDO LÁCTICO* (CICLO DE CORI)
Procedente de aminoácidos: *ALANINA* (CICLO DE GLUCOSA-ALANINA) y GLUTÁMINA
Procedente de lípidos: GLICEROL
Laura del Olmo
12
ALTERACIONES DE LA GLUCONEOGÉNESIS
Hipoglucemia
Es muy importante mantener un adecuado funcionamiento de la gluconeogénesis para mantener el nivel de glucosa
en sangre constante (homeostasis glucídica), si no puede tender a la hipoglucemia, que a quien primero daña es al
cerebro.
Grupos de riesgo:
Niños pequeños (hasta los 6-7 años). Es relativamente frecuente en niños pequeños cuando tienen un
periodo de ayuno (1 o 2 días), pueden caer en una hipoglucemia. En niños muy frecuente. Normalmente
tienen menos proteínas, liberan menos ala y gln, por lo que no pueden formar adecuadamente las vías
precursoras de la glucosa; en conclusión, tienen una gluconeogénesis más defectuosa que los adultos por lo
que les será más fácil tener problemas. Empiezan a tirar de grasa cuerpos cetónicos (daño cerebro).
Corregir inmediatamente porque como no hay glucosa tiran de la grasa y la degradación de mucha grasa
produce acetona.
Mujeres embarazas. También frecuente en el embarazo, sobre todo en ayuno nocturno, ya que el feto tira
de ala y gln para formar sus proteínas, por tanto disminuye el nivel de ala y gln disponible para realizar
gluconeogénesis vía proteínas.
Normalmente las embarazadas tienen una filtración tremenda por parte del feto, por lo que puede verse
falta de ala y gln.
Sustancias alterantes de la gluconeogénesis: Alcohol
Determinadas sustancias inhiben la gluconeogénesis, por ej. el alcohol.
¿Por qué? Porque la única manera de metabolizarlo es oxidándolo.
Se oxida a aldehído gastando NAD+, y después a acetato. Como muchos pasos de la gluconeogénesis precisan de
NAD+ (el principal sustrato de la gluconeogénesis, el ácido láctico, requiere de NAD+; Lac Pir), si no hay NAD+ no
se produce gluconeogénesis (o síntesis de G), y como el alcohol solo lo metaboliza el hígado que es el que hace el
90% de la gluconeogénesis, ésta se bloqueará.
Laura del Olmo
13
Por eso se dice que las calorías del alcohol son calorías vacías, porque no nos aportan nada (no contienen nutrientes
benéficos, como vitaminas y minerales) pues la energía del acetato solo se utilizará para sintetizar grasa (riesgo de
hígado graso en alcohólicos).
El alcohol en dosis pequeñas se metabolizará bien (especialmente si has comido; la tasa de absorción depende de la
cantidad y el tipo de comida dentro del estómago, por ejemplo, las comidas ricas en carbohidratos y grasas
disminuyen las tasas de absorción), pero en elevadas dosis se metabolizará mal, pues parte puede pasar a ser
absorbida por el estómago (metabolismo fuera del hígado).