Fisiologia Renal Final
description
Transcript of Fisiologia Renal Final

FISIOLOGIA RENAL Breve revisión de lo visto en teoría sobre la función, regulación y control de
fisiología renal
LUNES 30 DE NOVIEMBRE PRESENTAN: CHIMAL SEGURA FABIOLA, GARIBAY PEREZ MARIANA, CANJURA
LUNA KAREN LUCIA, MONDRAGON SARMIENTO FREDY OSWALDO, GÓMEZ FRANCO
GUSTAVO MISAEL 5QV2 equipo #1

1 Índice:
Pág. 2 Procesos básicos de la formación de orina
-Descripción de los conceptos clave -Funciones renales
Pág. 3 Filtración glomerular -presiones hidrostáticas y coloidosmoticas, presión efectiva de filtración. Tasa de filtración neta
Pág. 8 Secreción tubular
Pág. 9 Absorción tubular -absorción en el túbulo proximal, asa de Henle descendente y ascendente, absorción en el túbulo distal y colector cortical
Pág. 14 Regulación del balance acido base, hidroelectrolítico y la relación
de estos con la osmolaridad
Pág. 16 Regulación del pH
Pág. 19 Hormona ADH
-Receptores de la vasopresina
Pág. 21 Hormona aldosterona Pág. 22 Sistema renina-angiotensina Síntesis de aldosterona Mecanismo de acción de la aldosterona
Pág. 26 Sistema multiplicador contracorriente -Descripción del gradiente osmótico vertical
Bibliografía Pág. 29

2
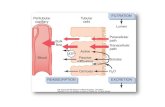
Procesos básicos de la formación de orina
Los elementos funcionales del riñón son las nefronas y los túbulos colectores hacia los que éstas drenan su producto. Es
esencial que todas las personas que estudian el riñón capten su significado con claridad. Filtración es el proceso por el que
el agua y los solutos de la sangre dejan el sistema vascular a través de la barrera de filtración e ingresan en el espacio de
Bowman (un espacio fuera del cuerpo desde el punto de vista topológico). La secreción es el proceso de desplazamiento
de las sustancias hacia la luz tubular desde el citosol de las células epiteliales que forman las paredes de la nefrona. Las
sustancias secretadas pueden originarse por síntesis dentro de las propias células epiteliales o, más a menudo, al cruzar
la capa epitelial desde el intersticio renal circundante. La resorción o reabsorción es el proceso consistente en hacer pasar
las sustancias desde la luz a través de la capa epitelial hacia el intersticio circundante. En la mayor parte de los casos las
sustancias resorbidas se desplazan luego del intersticio a los vasos sanguíneos circundantes, de modo que el término
reabsorción implica un proceso de dos etapas consistente en sacar de la luz estos materiales y después introducirlos en
la sangre. El término excreción significa hacer salir una sustancia del cuerpo (es decir, la sustancia se encuentra en la orina
final que los riñones producen). Síntesis se refiere a la elaboración de una sustancia a partir de precursores moleculares y
catabolismo, al desdoblamiento de una sustancia en moléculas componentes más pequeñas. El control renal de cualquier
sustancia comprende cierta combinación de los procesos que acaban de mencionarse. Si es posible responder a las
siguientes preguntas, se podrá saber lo que el riñón hace con una sustancia determinada. ¿Se filtra? ¿Se secreta? ¿Se
resorbe? ¿Se sintetiza? ¿Se cataboliza?
Funciones del riñón
El sistema urinario contribuye a la homeostasis al ayudar a regular el volumen, composición de electrolitos y pH del
ambiente interno y a eliminar los productos de desecho metabólico.
Los riñones realizan las siguientes funciones específicas, la mayoría de las cuales ayudan a preservar la constancia del
medio interno:
Mantener el balance H2O del cuerpo
Mantener la osmolaridad apropiada de los fluidos corporales
Regular la concentración de gran parte de los iones del LEC.
Mantener el volumen plasmático apropiado.
Ayudar a mantener el balance ácido-base
Excretar los productos finales (desechos) del metabolismo corporal.
Excretar compuesto exógenos
Producir eritropoyetina
Producir renina.
Convertir la vitamina D a su forma activa

3
Tabla #1. Resumen de las funciones renales por cada sección
Filtración glomerular La sangre debe ser filtrada para eliminar moléculas que el cuerpo ya no requiera, ya estén metabolizadas por completo o su alta concentración pueda dañar severamente al cuerpo. La parte que importa ser filtrada en la sangre es el plasma sanguíneo que será filtrada por las nefronas del sistema renal, recordemos que el plasma sanguíneo constituye un 55 % del volumen de la composición de la sangre, este será filtrado en el interior de la capsula de Bowman, por un glomérulo formado por varias arteriolas con una membrana funestada especializada.

4
Figura 1.Porsentaje de la composición del volumen sanguíneo. Se observa que el plasma sanguíneo forma parte del 55% del volumen de sangre.
La filtración glomerular La filtración glomerular es el paso de líquidos desde el capilar glomerular a la nefrona por procedimientos exclusivamente físicos. La energía necesaria para llevar a cabo la filtración es proporcionada por el corazón y no por los riñones.
Figura 2. Procesos renales básicos. Esquema sencillo de los principales procesos que realiza la nefrona como es la filtración, reabsorción y secreción. Consiste en el ultra filtrado del plasma (plasma libre de proteínas) desde los capilares glomerulares hacia la luz tubular, más particularmente, hacia el espacio de la cápsula de Bowman. El volumen y la composición del ultra filtrado dependen de varios factores: 1. El flujo sanguíneo renal. 2. La barrera de filtración. 3. La diferencia de presión entre el glomérulo y la cápsula de Bowman. 1. El flujo sanguíneo renal es el volumen de sangre que circula por los riñones en la unidad de tiempo. La filtración glomerular es directamente proporcional al flujo sanguíneo renal. Por eso, el alto porcentaje del gasto cardíaco que llega al riñón se explica mejor como una forma de garantizar un flujo suficiente, que posibilite la filtración, que como una necesidad para abastecer a este órgano (aunque, de hecho, se trata de un órgano metabólicamente muy activo). 2. La barrera de filtración está constituida por el endotelio del capilar glomerular, la membrana basal y la hoja interna de la cápsula de Bowman. Los capilares glomerulares son muy permeables, de tipo fenestrado, con un endotelio que presenta grandes poros. La membrana basal está formada por una red de colágeno y proteoglicanos. Esta membrana deja pasar libremente al agua y los solutos pequeños, pero retiene a las proteínas. Los proteoglicanos de la membrana basal están cargados negativamente. Esto hace que, a igual diámetro de las partículas, las que están cargadas positivamente pasen con más facilidad que las negativas, que son repelidas por las cargas de la membrana basal. La hoja interna de la cápsula de Bowman es una capa discontinua de células epiteliales, llamadas podocitos. Los podocitos tienen grandes expansiones parecidas a un pie, que rodean a los capilares glomerulares. Entre los pies hay espacios (los poros de rendija) por donde

5
se desliza el filtrado glomerular. La membrana glomerular es más gruesa que la de otros capilares, pero también es muy porosa, lo que la hace permeable. Los poros tienen un tamaño de 8 nm, aunque partículas más pequeñas, como la albúmina, no los atraviesan, debido a sus cargas negativas. En conclusión, los únicos impedimentos para la filtración son el tamaño de las partículas y sus cargas. La barrera de filtración retiene a las células sanguíneas y a las proteínas plasmáticas. El resto de los componentes del plasma pasa libremente hacia el espacio de la cápsula de Bowman.
Figura 3.Capsula de Bowman en podocitos con pedicelos y hendiduras de filtración. Esquema de la capa de filtración de un capilar envuelta por un podocito y sus pedicelos.
Presiones hidrostáticas y coloidosmótica. Presión efectiva de filtración
La presión hidrostática se debe al bombeo del corazón, que empuja la sangre a través de los vasos, y por eso ésta intenta escapar a través de los capilares. La presión oncótica o coloidosmótica se debe a las proteínas, que están más concentradas en la sangre que en los tejidos, y por osmosis el líquido va hacia los vasos para equilibrar las concentraciones de proteínas. La presión oncótica se mantiene más o menos estable, pero la hidrostática primero es más alta y luego va cayendo a medida que la sangre avanza por los vasos. Por eso al principio el plasma puede escapar de los capilares, pero luego regresa a ellos. La filtración depende de la suma de presiones hidrostáticas y coloidosmóticas (oncóticas) que actúan sobre la barrera de filtración, favoreciendo la filtración u oponiéndose a ella. La presión efectiva de filtración resultante es: Presión efectiva de filtración = 55 mm Hg – (15 mm Hg + 30 mm Hg) = 10 mm Hg)
Tabla 2.Comparaciones entre las presiones que favoreces al filtrado glomerular y las que se oponen
Favorecen la filtración Se oponen a la filtración
Presión hidrostática glomerular (presión sanguínea) = 55 mm Hg
Presión hidrostática en la cápsula de Bowman = 15 mm Hg
Presión coloidosmótica en la cápsula de Bowman. Esta fuerza es despreciable, ya que el filtrado prácticamente no contiene proteínas.
Presión coloidosmótica glomerular = 30 mm Hg

6
Procedimiento de la filtración glomerular
El fluido filtrado del glomérulo a la capsula de Bowman debe pasar a través de las tres capas que conforman la membrana glomerular:
La pared capilar glomerular
La membrana basal
La capa interna de la capsula de Bowman La pared capilar glomerular es una sola capa de células endoteliales aplanadas que forman poros de gran tamaño lo cual la hace 100 veces más permeable al H2O y solutos.
Figura 4. Capilares con fenestraciones a la izquierda y filtración de solutos través de la barrera de filtración a la derecha.
La membrana basal es una capa gelatinosa a celular compuesta de proteínas como colágeno y glucoproteínas que se única entre el glomérulo y la capsula de Bowman. El colágeno provee fuerza estructura y las glucoproteínas se resisten a la filtración de proteínas plasmáticas pequeñas por su carga negativa, repeliendo proteínas positivas como la albumina y a otras proteínas plasmáticas con igual carga negativa. La capa interna de la Capsula de Bowman, está formada en su mayoría por podocitos, células especializadas con proyecciones elongadas que rodean la cresta glomerular. Las pequeñas rendijas entre las proyecciones se conocen como hendiduras de filtración, que proveen una vía a través de la cual el fluido que deja los capilares glomerulares puede entrar al lumen de la cápsula de Bowman.
Figura 5. Capas de la membrana glomerular. Localización y distribución de las capas que conforman la barrera de filtración.

7
La filtración ocurre en la barrera entre la sangre y el filtrado en el corpúsculo renal o la cápsula de Bowman en los riñones. La cápsula de Bowman contiene una densa red capilar llamada glomérulo. La sangre fluye en estos tubos capilares a través de una ancha arteriola aferente y se va a través de una más estrecha arteriola eferente. La arteria renal contiene sangre a una muy alta presión que entra al glomérulo vía la corta arteriola aferente, la arteriola eferente tiene un diámetro más pequeño que la arteriola aferente y la presión arterial dentro de estos tubos capilares es alta porque:
La arteria renal contiene sangre a una muy alta presión que entra al glomérulo vía la corta arteriola aferente.
La arteriola eferente tiene un diámetro más pequeño que la arteriola aferente.
La alta presión obliga a moléculas pequeñas de un promedio máximo de 70 kilo Dalton tales
como agua, glucosa, aminoácidos, cloruro de sodio y urea pasen a través del filtro, desde la sangre en la cápsula
glomerular a través de la membrana basal de la cápsula de Bowman hacia el nefrón. La ultrafiltración es este tipo
de filtración de alta presión. El fluido formado de esta manera es llamado filtrado glomerular. Las moléculas
grandes como las de proteína del plasma y las células sanguíneas no pasan a través del filtro porque son
demasiado grandes.
Figura 6. Cápsula de Bowman con sus respectivas partes anatómicas. Se muestra el tamaño de las arterias aferente
y eferente.
Índice o Tasa de filtracion neta
El Índice o tasa de filtrado glomerular es el volumen de fluido filtrado por unidad de tiempo desde los
capilares glomerulares renales hacia el interior de la cápsula de Bowman. Normalmente se mide en mililitros por minuto
(ml/min).
La tasa o índice de filtrado glomerular o presión efectiva de filtración es la fuerza física y neta que produce el transporte de agua y de solutos a través de la membrana glomerular. Esta fase depende de: La presión hidrostática del capilar glomerular. La presión hidrostática a nivel de la cápsula de Bowman. La presión oncótica a nivel capilar glomerular

8
Figura 7. Filtracion Eficaz Glomerular
(PFG) originada por la interaccion de
preciones que existe en la filtracion
glomerular.
Presión eficaz de filtración (PFG) = Presiones a favor de la filtración – Presiones en contra. • Presiones a favor = Presión arterial (Presión hidrostática capilar) + Presión coloidosmótica en el espacio de Bowman. • Presiones en contra = Presión hidrostática en el espacio de Bowman + Presión coloidosmótica capilar. La diferencia entre presiones da como resultado la Presión eficaz de filtración, en la parte de abajo se encuentra una pequeña operación matemática con la cual se muestras la Presión Eficaz ya con valores establecidos reales.
1. Presión hidrostática capilar o presión arterial: 55 mm Hg (~constante). 2. Presión hidrostática en la cápsula de Bowman: 30 mm. Hg. 3. Presión coloidosmótica capilar: 15 mm. Hg. 4. Presión coloidosmótica en el espacio de Bowman: 0 mm. Hg.
PFG= 55 mmHg – (30 mm Hg + 15 mm Hg) = 10 mm Hg
Secreción tubular
Transferencia discreta de sustancias desde los capilares peritubulares hacia el lumen tubular, es un mecanismo
suplementario que detiene la eliminación de estos compuestos. Provee una segunda ruta de entrada hacia los túbulos
para sustancias seleccionadas. Las sustancias más importantes secretadas por los túbulos son el ion hidrogeno (H+), el ion
potasio (K*), y aniones orgánicos, muchos de los cuales son compuestos foráneos al cuerpo.
Figura 8

9
REABSORCIÓN TUBULAR A medida que el filtrado glomerular pasa por la totalidad de los túbulos renales, fluye de forma secuencial a través de sus diferentes partes (el túbulo proximal, el asa de Henle, el túbulo distal, el túbulo colector y, finalmente, el conducto colector) antes de eliminarse la orina. A lo largo de éste recorrido algunas sustancias se reabsorben selectivamente volviendo a la sangre, mientras que otras se secretan desde la sangre a la luz tubular. La reabsorción tubular es cuantitativamente importante y altamente selectiva
1. Los procesos de filtración glomerular y reabsorción son muy intensos en comparación con la excreción urinaria. Esto significa que un pequeño cambio de la filtración glomerular o en la reabsorción podría causar un cambio relativamente grande en la excreción urinaria.
2. La reabsorción tubular es muy selectiva. Por ejemplo la glucosa y los aminoácidos se reabsorben al 100% en los túbulos por lo que la excreción urinaria es prácticamente nula o iones plasmáticos (Na+, Cl-, HCO3-) dependen de las necesidades del cuerpo para ser reabsorbidos o excretados. En cambio productos de desecho como creatinina (producto final del metabolismo muscular) no son reabsorbidos y por lo tanto se excretan.
Figura 9
Figura 10

10
Tabla3. Filtración, reabsorción y excreción de diferentes sustancias por los riñones
Reabsorción en túbulo proximal: Alrededor del 65% de la carga filtrada de Na+ y H2O y pocas moléculas de Cl- se reabsorbe, normalmente, en el túbulo proximal antes de llegar al asa de Henle. Estos porcentajes pueden aumentar o disminuir en diferentes condiciones fisiológicas. Los túbulos proximales tienen una alta capacidad de reabsorción y esta se debe a las características de las células epiteliales que podemos observar en la Figura.
Figura 11. Células epiteliales tubulares proximales, señalando con
flechas el borde en cepillo. (H&E, X400)
Debido al alto metabolismo de las células tienen un gran número de mitocondrias para apoyar los potentes procesos de
transporte activo. Además las células tubulares proximales tienen un borde en cepillo extenso en el lado apical (luminal)
de la membrana, así como un laberinto extenso de canales intercelulares y basales, los cuales proporcionan una superficie
de membrana extensa en los lados luminal y basolateral del epitelio para un transporte rápido de los iones Na+,
principalmente y otros sustancias.

11
Figura12. Mecanismos de reabsorción en
túbulo proximal
Muestra el cotransporte de la glucosa y de los aminoácidos junto al de los iones sodio a través del lado apical de las células epiteliales tubulares, seguido de la difusión facilitada a través de las membranas basolaterales, el cotransporte de iones hidrógeno desde el interior de la célula a través de la membrana apical y hacia la luz tubular; el movimiento de iones sodio al interior de la célula, siguiendo el gradiente eléctrico establecido por la bomba sodio-potasio en la membrana basolateral, proporciona la energía para el transporte de los iones hidrogeno desde el interior de la célula hacia la luz tubular. GLUT, transportador de glucosa; NHE, intercambiador de sodio-hidrogeno; SGLT, Cotransportador de sodio-
glucosa. En esta porción también son reabsorbidas proteínas mediante un proceso de pinocitosis, es ayudado de igual forma por el epitelio característico de esta porción de los túbulos renales. La pinocitosis es un mecanismo de transporte activo y se basa en los siguientes pasos: 1. La proteína se une al epitelio tubular y se forma una invaginación hacía el interior hasta formar una vesícula 2. Una vez dentro de la célula la proteína se digiere en aminoácidos
3. Se reabsorben a través de la membrana basolateral hacía el líquido intersticial
Mecanismos de reabsorción en asa de Henle. Porción descendente La rama descendente tiene afinidad al agua y a la mayoría de los solutos, primordialmente urea, mediante canales pasivos, Na+, y al agua por ósmosis. La función de este segmento de la nefrona es sobre todo permitir la difusión simple de la sustancias a través de las paredes. Alrededor del 20% del agua filtrada se reabsorbe en el asa de Henle porción descendente.
Figura13. Esquema general del proceso pinocitosis

12
Mecanismos de reabsorción en asa de Henle. Porción ascendente
Ambas porciones fina y gruesa, son casi impermeables al agua pero permeables a solutos, una característica importante para concentrar la orina. Alrededor del 25% de las cargas filtradas de sodio, cloro, y potasio se reabsorben en reabsorben en el asa de Henle. También es considerable la reabsorción de otros iones como calcio, bicarbonato y magnesio, en la rama ascendente gruesa del asa de Henle. El segmento fino de la rama ascendente tiene una capacidad de reabsorción mucho menor que el segmento grueso.
Figura 14. Muestra el transporte por acuaporinas del agua, canales pasivos para urea, Na+ y el transporte paracelular del Na+
Figura15. Muestra el megatransportador, el transporte paracelular de Na+, Mg2+, Ca2+,K+, transporte pasivo de Na2+ y la bomba de Na+-K+ ATPasa

13
Mecanismo de reabsorción en túbulo distal y túbulo colector cortical El segmento grueso de la rama ascendente del asa de Henle se vacía en el túbulo distal. La porción inicial del túbulo distal conforma la mácula densa, un grupo de células epiteliales densamente empaquetadas que es parte del complejo yuxtaglomerular que proporciona un control de retroalimentación del filtrado glomerular y del flujo sanguíneo en esta nefrona. La siguiente parte del túbulo distal está muy contorneada que reabsorbe con avidez la mayoría de los iones, incluidos el sodio, el potasio y el cloro, pero es casi totalmente impermeable al agua y a la urea. Está compuesto de dos tipos de células especiales, las intercaladas y las principales. Las células principales reabsorben sodio, agua y secretan iones de potasio hacía la luz tubular. Las células intercaladas reabsorben iones potasio y secretan iones hidrógeno a la luz tubular, la cantidad de iones hidrógeno excretados es dependiente de la necesidad del cuerpo para elevar o disminuir el pH.
Figura16. Secreción activa de H+ a través de la membrana luminal de las células epiteliales intercaladas de la porción final del túbulo distal y el túbulo colector. Se absorbe un ion por cada HCO3
- por cada H+ secretado, y que se secreta de forma pasiva un ión cloro con el H+
Aunque la secreción de H+ en la porción final del túbulo distal y en los túbulos colectores sólo representa un 5% de la cantidad total de H+ secretada, se trata de un mecanismo importante para la formación de una orina con la máxima acidez.
Cuando se secretan más H+ al líquido tubular que HCO3- se ha filtrado, sólo una parte del exceso de H+ puede excretarse en la forma iónica (H+) por la orina. La excreción de grandes cantidades de iones hidrógeno (en ocasiones incluso 500 meq/día) por la orina se logra fundamentalmente combinando el H+ con los amortiguadores presentes en el líquido tubular. Los más importantes son los amortiguadores fosfato y amoníaco.
Figura17. Amortiguación de iones hidrógeno secretados por el fosfato filtrado (NaHPO4
-). Obsérvese que se devuelve un nuevo ion HCO3-
a la sangre por cada NaHPO4
-, que reacciona con un H+
secretado.

14
Figura18. Amortiguación de la secreción de ion hidrógeno por el amonio (NH3) en los túbulos colectores. El amonio se difunde hacia la luz tubular, donde reacciona con los H+ secretados para formar NH4
-, que después se excreta. Por cada NH4
+ excretado se forma un nuevo HCO3-
en las células tubulares que vuelve a la sangre.
Regulación del balance acido base y el balance electrolítico, regulación de la osmolaridad.
Para regular la sal y el agua, los riñones regulan en realidad cuatro cantidades de manera simultánea: equilibrio del agua,
equilibrio de la sal, osmolalidad y presión arterial
Los dos primeros aspectos parecen ser directos: los riñones regulan la excreción de agua y la de sal para establecer el
equilibrio con su ingreso. La osmolalidad es más complicada porque no es una sustancia que tenga un ingreso y una
excreción; más bien es la razón de sustancias (solutos y agua). En esencia, la osmolalidad plasmática es la razón entre el
contenido corporal de sodio (y sus aniones acompañantes) y el de agua. Por tanto, cualquier cambio en el equilibrio de
agua y el de sodio modifica la osmolalidad. En última instancia la presión arterial es quizá el aspecto regulado más
importante. La presión arterial resulta crucial en el equilibrio de sal y agua porque desempeña una función enorme en la
generación de señales que alteran la excreción de agua y sodio por los riñones.
Tres mecanismos primarios regulan la secreción de renina. Primero, cuando la presión arterial disminuye, la actividad
nerviosa simpática renal incrementa y activa los receptores adrenérgicos beta, sobre las células granulosas de la arteriola
aferente para que estimulen la secreción de renina. Segundo, las células granulosas actúan también como
"barorreceptores renales" Éstos responden a los cambios de presión dentro de la arteriola aferente, que, salvo en los
casos de estenosis arterial renal, es un reflejo de los cambios en la presión arterial sistémica. La deformación de las
membranas de las células granulosas altera la secreción de renina: cuando la presión cae, la producción de renina
aumenta. Tercero, las células de la mácula densa que se encuentran en la rama gruesa ascendente perciben la liberación
de cloruro de sodio mediante un cambio de la captación de sal, con tumefacción osmótica subsecuente. Los cambios en
el volumen celular liberan transmisores químicos que alteran la secreción de renina de las células granulosas: la
producción de renina disminuye cuando la liberación de cloruro de sodio aumenta. Ejemplificación del Control de la
reabsorción de agua por una situación hipotética de hemorragia y su relación con diferentes mecanismos de control como
la presión arteriolar (mediante la secreción de vasoconstrictores) y la osmolaridad

15
Fig. 19. Control de la excreción del
sodio y del agua
fig20. Control de la secreción de renina.

16
Regulación del pH La alteración del pH fisiológico puede ser causada por la ingesta de ácidos y bases además de la producción metabólica de ácidos (ácidos de origen respiratorio y ácidos de origen proteico) Existen 3 niveles principales para contrarrestar cambios de pH: Amortiguador a nivel intracelular y extracelular Regulación pulmonar Regulación renal En el primer nivel existen diferentes amortiguadores o buffers es un sistema formado por un ácido débil y una sal fuerte de dicho ácido, que funciona como base cuya misión es amortiguar, es decir, disminuir los cambios de acidez de una solución cuando a ésta se le añade un ácido o un álcali y conseguir, por lo tanto, que el pH de la solución cambie lo menos posible; su efecto es prácticamente inmediato. Los buffers del compartimento extracelular son los siguientes: a) Bicarbonato/CO2, en el plasma y líquido intersticial. b) Hemoglobina, en los hematíes. c) Proteínas plasmáticas. d) Fosfato disódico/fosfato monosódico, en plasma, hematíes y líquido intersticial. La segunda línea de defensa actúa amortiguando la acidez o alcalinidad a base de eliminar o retener CO2, lo que disminuye o aumenta el ácido carbónico, y en consecuencia la [H+]. En condiciones normales todos los ácidos volátiles producidos han de ser eliminados por el pulmón en su práctica totalidad. El CO2 tisular, procedente del metabolismo, se mueve hacia el plasma, donde tiene las siguientes posibilidades: a) Disolverse físicamente, de acuerdo con la pCO2 b) Hidratarse a bicarbonato, en una mínima cantidad, porque en el plasma no se encuentra abundante anhidrasa carbónica c) En su mayor parte, pasar al hematíe, una vez dentro del mismo, una parte se disuelve, otra se convierte a bicarbonato, ya que en el hematíe hay abundante anhidrasa carbónica, y otra parte se une a la Hemoglobina (Hb) formando compuestos carbamino. El H2 CO3 formado se disocia en H+ + CO3H-, la unión del CO2 a la Hb libera también un H+, el cual es neutralizado para evitar el descenso de pH.
El tercer nivel está en los túbulos renales, Normalmente se producen H+ entre 50 y 100 meq/día, aunque en condiciones
patológicas pueden producirse hasta 500 meq/día, que se neutralizan con los buffers extra e intracelulares, pero han de
ser eliminados por el riñón, ya que el pulmón no excreta H+. El riñón contribuye al balance ácido-base regulando la
excreción de H+ en tanto que la concentración de CO3H- permanezca dentro de límites apropiados. Esto involucra dos
pasos básicos:
A) La reabsorción tubular del bicarbonato filtrado en el glomérulo: Todo el bicarbonato plasmático (4.500 - 5.000 meq/día)
se filtra en el glomérulo. Si el pH de la orina es < 6.2, no hay nada de bicarbonato en la orina, lo que indica que se ha
reabsorbido todo en el túbulo. Cuando el pH urinario es > 6.2 aparece el bicarbonato en la orina. La reabsorción tubular
de bicarbonato aproximadamente el 90% se realiza en el túbulo proximal, en los primeros milímetros de este segmento.
Parece estar mediada por el incremento en el número de cotransportadores Na+/ H+, el restante 10% restante se
reabsorbe en segmentos más distales, en los túbulos colectores medulares más externos. La reabsorción de bicarbonato
por el túbulo depende de varios factores:
1. De la cantidad de bicarbonato presente en el túbulo que es prácticamente lineal hasta un nivel de 24-25 meq/l, si es
inferior a este nivel el bicarbonato plasmático todo se reabsorbe en el túbulo. A partir de dicho nivel, el que se reabsorba
más o menos depende de los siguientes factores.

17
2. Nivel de pCO2, si aumenta en el plasma, y en consecuencia en la célula tubular, aumenta la concentración de H+
aumentando su eliminación y en consecuencia se reabsorbe más bicarbonato; y si disminuye, se reabsorbe menos.
3. Grado de repleción del volumen extracelular, su expansión disminuye la reabsorción proximal de bicarbonato y su
contracción aumenta la reabsorción de bicarbonato.
4. Nivel de mineralcorticoides (y en menor medida de glucocorticoides); si está aumentado, aumenta la reabsorción de
bicarbonato; y si está disminuido, disminuye.
5. Nivel de K+ plasmático, si está bajo, aumenta ligeramente la reabsorción de bicarbonato probablemente por estímulo
de la producción de renina - aldosterona. La hipopotasemia genera alcalosis metabólica. B) La regeneración del
bicarbonato gastado en la neutralización del ácido fijo, mediante la eliminación de H+:
1. Se alcanza mediante la secreción de H+, con dos mecanismos diferentes, en el túbulo proximal cotransporte Na-H+, y
en los túbulos colectores por un mecanismo de transporte activo primario, con un transportadora de iones hidrógeno (H+-
ATPasa), manteniendo la electroneutralidad por la secreción concurrente de Cl-. Este último mecanismo puede aumentar
la concentración de hidrógeno en la luz tubular hasta 900 veces, que puede disminuir el pH del líquido tubular hasta 4.5,
que es límite inferior de pH que se mide en la orina, en contraste con el incremento de tres a cuatro veces que puede ser
obtenido en los túbulos proximales. En condiciones normales, la velocidad de secreción de H+ es de 3.5 mol/min y la
velocidad de filtración de bicarbonato es de 3.46 mmol/min, es decir la cantidad de ambos iones es prácticamente la
misma, neutralizándose en la luz tubular. Por tanto la excreción directa de H+ libres, es mínima de 0.1 meq/día como
máximo.
2. Así pues, para eliminar el exceso de H+ por la orina, se debe combinar este con buffers:
I. Como acidez titulable
a) en forma de fosfato: HPO42-+ H+ = H2PO4-; este sistema tiene un pKa de 6.8, y por tanto es activo entre 7.3 y 6.3 de
pH.
b) en forma de creatinina: es cuantitativamente poco importante, su interés es por tener un pKa de 4.8, y poder actuar
en los rangos bajos del pH urinario.
II. Como amonio: El túbulo renal sintetiza amoniaco a partir de la glutamina a partir de una de las siguientes vías:
Glutamina: 3CO2 + 2NH4+ + 2HCO3 - ;
glutamina: ½ glucosa + 2NH4+ + 2HCO3 –
Una vez formado, el bicarbonato vuelve a la circulación sistémica a través de la vena renal. Si el amonio no se excreta a la orina y retorna a la circulación sistémica, se metaboliza en el hígado donde se metaboliza a urea consumiendo bicarbonato. Por tanto, dos mecanismos regulan la producción de bicarbonato renal de la amoniogenesis renal: 1) el balance de distribución del amonio entre la circulación sistémica y la orina; y 2) la velocidad de producción de amonio renal. La producción de amonio puede estar influida por factores al margen del estado ácido-base, como son la masa renal reducida, cambios en el volumen circulante, alteraciones en el potasio y calcio El amoniaco es un gas, que difunde con facilidad hacia la luz del túbulo, dónde se combina con los H+ procedentes del H2CO3, que se han intercambiado previamente por Na+, formando amonio: NH3 + H+ = NH4
+, que es un catión, muy poco difusible a través de la membrana de la célula tubular (no existe transporte activo de amonio), por lo que queda “atrapado” en la luz tubular, eliminándose con la orina. De esta forma se eliminan normalmente 20 a 40 meq/día de H+, pudiendo incrementarse hasta 250 meq/día o más en las acidosis metabólicas severas. Este mecanismo es fundamental en los niños pequeños, en los que el mecanismo de acidez titulable está poco desarrollado. Mediante estos mecanismos, por cada H+ que se elimina por la orina, se retiene, y se reabsorbe, un bicarbonato. En la acidosis se excretan H+ por el riñón, tanto los procedentes de ácidos fijos como del ácido carbónico, es decir, tanto de la acidosis metabólica como respiratoria. En el caso de que el bicarbonato se hubiera gastado previamente en la neutralización del ácido fijo, esto supone regenerar el bicarbonato gastado; en el caso de la eliminación de H+ procedente

18
del ácido carbónico, la reabsorción secundaria de bicarbonato supone elevar el bicarbonato plasmático por encima de sus niveles normales, que es lo que ocurre en la compensación metabólica de la acidosis respiratoria crónica. En la alcalosis, tanto metabólica como respiratoria, se retienen H+ al mismo tiempo que se excreta el bicarbonato, que desciende en el plasma. La cantidad neta de H+ excretados en orina es igual a la cantidad de H+ excretados como acidez titulable y NH4
+ menos cualquier H+ añadido por la pérdida de CO3H- urinario.
Figura21. Relación del HCO3- producido en el
riñón y pCO2 en los pulmones
Existen estructuras especializadas en las arterias que sirven para regular el pH: el cuerpo carotideo es un quimiorreceptor que vigila los cambios en las concentraciones de oxígeno y dióxido de carbono así como los valores del H+ (pH) que son producidos por los mecanismos anteriores. Se encuentra en la bifurcación de la arteria carótida primitiva. Tiene dos tipos de células especializadas: glómicas y de la vaina y los cuerpos aórticos que se encuentra en el cayado de la aorta que tiene funciones similares a las del cuerpo carotideo. El cuerpo carotideo: detectan la PCO2 y el pH arteriales: cuando la PCo2 o la concentración de H+ aumentan, los CC (junto con los quimiorreceptores centrales y alguna contribución de los cuerpos aórticos) inician una hiperventilación refleja que tiende a descargar el exceso de CO2 y de H+ a la atmósfera; esto es, los CC tienen una importante función homeostática en relación con el CO2 y los H+. El CC es un órgano par situado en las proximidades de las bifurcaciones carotideas y que en el hombre adulto tiene en torno a 2 mm de diámetro, reciben inervación sensorial a través del NSC. Las fibras sensoriales provienen de neuronas que se asientan en el ganglio glosofaríngeo inferior, petroso o ganglio de Andersch (muy pocas fibras provienen del ganglio glosofaríngeo superior o de Ehrenritter) y llegan al CC a través del NSC, para penetrar en los islotes celulares y formar sinapsis con las células quimiorreceptoras. Además de la inervación sensorial a las células glómicas y simpática a los vasos, al CC llega inervación parasimpática procedente de neuronas presentes en la superficie del CC, donde forman microganglios, y de neuronas dispersas a lo largo del NSC y en la entrada del NSC en el glosofaríngeo. Estas fibras son nitrérgicas; controlan el flujo sanguíneo al CC y, a su través, la actividad funcional del CC. Los CC están formados por islotes o nidos celulares, que constituyen el parénquima glómico, y que están rodeados por tabiques de tejido conectivo. Los nidos celulares están formados por dos tipos celulares, las células glómicas, quimiorreceptoras o tipo I, y las células sustentaculares, capsulares o tipo II. Las primeras son redondas u ovoides, poseen un citoplasma rico en vesículas de núcleo denso y tienden a ocupar el centro de los islotes; las segundas son aplanadas, no poseen especializaciones citoplásmicas y se sitúan en la periferia de los islotes celulares. Las células tipo II son consideradas células de soporte de naturaleza neuroglial.

19
Figura 22 relaciones entre el SNC y la regulación renal
HORMONA ANTIDIURÉTICA O VASOPRESINA.
La hormona antidiurética (ADH), o arginina vasopresina (AVP), es una hormona liberada principalmente en respuesta a cambios en la osmolaridad sérica o en el volumen sanguíneo. Las vasopresinas son hormonas péptidas producidas en el hipotálamo. La mayoría se almacenan en la parte posterior de la glándula pituitaria (neurohipófisis) con el fin de ser liberadas en la corriente sanguínea, siendo algunas de ellas liberadas incluso directamente en el cerebro. Los receptores de vasopresina pertenecen a la superfamilia de receptores de proteína G con siete dominios transmembrana. Se han descrito cuatro subtipos de receptores cuya localización, densidad y distribución determinan los diferentes efectos fisiológicos.
TABLA #4 .Resumen de los estímulos que afectan la secreción de la vasopresina.
Aumento de la secreción de vasopresina. Disminución de la secreción de la vasopresina.
Aumento de la presión osmótica
efectiva del plasma
Disminución del volumen de líquido
extracelular
Dolor, emociones, estrés y ejercicio.
Náuseas y vomito.
Posición de pie
Disminución de la presión osmótica
efectiva del plasma
Aumento del volumen de líquido
extracelular
Alcohol

20
Tabla #5 característica de los receptores para vasopresina.
Funciones.
Actúa en la porción final del túbulo distal y en los tubos colectores renales. Provoca un aumento de la reabsorción
de agua (mayor expresión de canales de acuaporina 2 en membranas). Este aumento de la reabsorción provocará:
Disminución de la osmolaridad plasmática
Aumento del volumen sanguíneo, retorno venoso, volumen latido y por consecuencia aumento del gasto cardiaco
(GC) La hormona vasopresina promueve la retención de agua desde los riñones. Así, altas concentraciones de vasopresina provocan una mayor retención renal de agua, y se excretaría la cantidad justa para eliminar los productos de desecho. Es por esto que durante una deshidratación los niveles de vasopresina están altos: para así evitar la pérdida de agua.
Receptores de la vasopresina o ADH.
La aquaporina-2 se localiza en la membrana apical y en vesículas intracelulares de las células principales de los túbulos
colectores. Este canal de agua está regulado por la vasopresina de dos maneras: a) un mecanismo de regulación a corto
plazo asociado con una redistribución intracelular de la aquaporina desde las vesículas intracelulares a la membrana
plasmática apical, y b) una regulación a largo plazo asociada con un aumento en la cantidad total de aquaporina-2 en la
célula. La vasopresina se une al receptor V2 de la membrana basal de las células principales de los túbulos colectores. Éste
es un receptor proteico unido a la proteína G (GTP-binding protein). La unión con el receptor activa la adenilciclasa, que
acelera la producción de adenosinmonofosfato cíclico (AMPc) a partir de adenosintrifosfato9. Posteriormente, el AMPc se
une a la subunidad reguladora de la proteína cinasa A (PKA) produciendo la disociación de la subunidad reguladora de la
subunidad catalítica. La subunidad catalítica de la PKA se activa al disociarse y fosforila diversas proteínas, entre ellas la
aquaporina-2. La fosforilación de la aquaporina-2 produce una translocación de las vesículas intracitoplasmáticas, que
contienen la aquaporina-2 fosforilada, a la membrana plasmática apical. El resultado final es un aumento de la
permeabilidad al agua de los túbulos colectores. Posteriormente, al disminuir las concentraciones de vasopresina se
produce un mecanismo de endocitosis de los canales de agua de la membrana apical que conduce a una disminución de
la permeabilidad del epitelio tubular. Por otro lado, la regulación de la transcripción del gen de la aquaporina-2 se realiza
a través de un mecanismo dependiente de la AMPc. El extremo 5' del gen de la aquaporina-2 presenta una secuencia de
respuesta al AMPc denominada cAMP responsive element (CRE). Parece que la unión de una proteína previamente
fosforilada a esta zona del gen (CRE-binding protein) favorece la transcripción del mismo y conduce a un aumento en su
ARNm y finalmente de la proteína (fig. 2). Recientemente se ha observado en ratones transgénicos (DI +/+) que, de manera

21
constitutiva, presentan un incremento en la actividad AMPc fosfodiesterasa y, por tanto, bajas concentraciones celulares
de AMPc, una poliuria intensa y una marcada disminución en la expresión renal de aquaporina-211. Se ha observado
también que el contenido celular de esta aquaporina-2 aumenta en respuesta a la restricción hídrica en ratas normales o
en respuesta a la infusión de vasopresina en las ratas Brattleboro (que carecen de vasopresina endógena circulante).
Figura #23. Receptores de la
vasopresina para la liberación
de acuaporina 2.
HORMONA ALDOSTERONA.
El sistema renina-angiotensina-aldosterona (SRAA) desempeña un importante papel en la regulación de la homeostasis
hidroelectrolítica y de la presión arterial y su activación está implicada en la génesis de la hipertensión arterial, la
cardiopatía isquémica y la insuficiencia cardiaca y renal, así como de diversas arritmias cardiacas.
El primer paso en la activación del sistema renina-angiotensina II-aldosterona es la liberación de la renina en respuesta a
gran variedad de estímulos (en las células yuxtaglomerulares del riñón), como disminución de la ingesta de sodio,
disminución del volumen extracelular o del volumen sanguíneo, aumento en la actividad simpática de los nervios renales,
disminución de la carga de sodio que llega a la macula densa y disminución de la presión de perfusión renal, la angiotensina
II, las prostaglandinas y la vasopresina y el potasio también estimulan la liberación de renina a través del aumento de
niveles de AMPc intracelular que se asocian a la disminución reciproca en calcio citoplasmático de las células
yuxtaglomerulares.
Los mecanismos más importantes que participan en la regulación de la liberación de la renina son:
Aumento en la concentración de potasio en el LEC.
Las señales de la macula densa
La activación de los barorreceptores vasculares renales
Modificaciones de la actividad nerviosa y de las catecolaminas circulantes.
También participan otros factores como la vasopresina, péptidos auriculares, adenosina, potasio, y las concentraciones
elevadas de angiotensina II que tienen un efecto inhibitorio.
La liberación de renina está regulada por mecanismos como el barorreceptor intrarrenal, la mácula densa (MD) y el sistema
nervioso simpático. Desde la MD son liberadas prostaglandinas vasodilatadoras (PG) como PGI2 y PGE2, generadas por la
ciclooxigenasa 2, que inducen la liberación de renina de las células yuxtaglomerulares.

22
INTERACCIÓN DE LA CICLOOXIGENASA-2 CON EL SISTEMA RENINA ANGIOTENSINA.
La renina es la enzima limitante para la formación de Ang II, se libera de las células yuxtaglomerulares que se encuentran
en el aparato yuxtaglomerular, el cual es una región de contacto especializado entre el glomérulo y la porción ascendente
gruesa del asa de Henle cortical, desempeña un papel activo en el mantenimiento de la homeostasis iónica, en el control
de la presión arterial y en la liberación de renina (24). El aparato yuxtaglomerular consta de un componente tubular, la
mácula densa, y un componente vascular que consiste en las arteriolas aferentes y eferentes, así como de un mesangio
extraglomerular.
El aparato yuxtaglomerular se encuentra formado por varios tipos de células como las células del músculo liso vascular,
células endoteliales, células mesangiales, células de la MD, y células granulares yuxtaglomerulares secretoras de renina
(Figura # ). Otros estudios han mostrado expresión de renina en otras regiones de la nefrona como el conducto colector.
Sin embargo, la mayor producción de esta enzima se lleva a cabo en las células yuxtaglomerulares donde es regulada por
el barorreceptor intrarrenal, la mácula densa y el sistema nervioso simpático. Barorreceptor intrarrenal.
El barorreceptor se encuentra localizado en la vasculatura renal. Específicamente en la arteriola aferente y su función es
sensar los cambios en la presión sanguínea. En perros concientes mostraron que el barorreceptor intrarrenal se activa
cuando disminuye la presión sanguínea de 100 a 60 mmHg, lo que estimula la liberación de renina hasta 7 veces, mientras
que el incremento de la presión sanguínea de 100 a 140 mmHg inhibe la liberación de renina
Figura #24. Aparato yuxtaglomerular: Existen tres vías principales que regulan la liberación de renina. El
barorreceptor intrarrenal, la mácula densa y el sistema nervioso simpático y a través del AMP cíclico, inducen
la liberación de renina de las células yuxtaglomerulares. Varios agonistas (por ejemplo, PGE2, norepinefrina,
y PGI2), a través de sus receptores específicos, convergen en la activación de las proteínas Gsα que activan a la
adenilato ciclasa (AC5 y 6) e incrementa la concentración de monofosfato de adenosina cíclico (AMPc). La unión

23
del AMPc a la subunidad reguladora de la proteína cinasa A (PKA) da lugar a la liberación de la subunidad
catalítica; en el núcleo PKA fosforila a la proteína CREB que se une al elemento de respuesta al AMPc (CRE)
ubicado en el DNA. La proteína CREB se une a la región del promotor del gen de renina para iniciar su
transcripción.
Los mecanismos que dependen del estímulo causado por la liberación de renina y angiotensina II, ayudan a hacer mínimas
las perdidas renales de líquido y sodio, así como mantener la presión arterial, por lo que también intervienen otros
estímulos relacionados con la homeostasis de los líquidos del organismo.
La angiotensina II (Ang II) es el producto principal de una serie de reacciones enzimáticas que ocurren en la circulación
general (SRAA). Se ha establecido que la Ang II actúa en forma endocrina para mantener la presión arterial y el balance
hidroelectrolítico. Sin embargo, cada vez son más las acciones de la Ang II descritas, por ejemplo funciones tisulares
altamente específicas como la secreción de citosinas y la proliferación celular.
La Ang II tiene una vida media biológica en la circulación que va de 15 a 60 segundos y constituye el producto final con
mayor actividad biológica del SRA. La Ang II actúa en el músculo liso vascular, se considera un agente muy potente que
aumenta la presión sanguínea inclusive más que la noradrenalina. También actúa en la zona glomerulosa de la corteza
suprarrenal estimulando la biosíntesis y secreción de aldosterona, en el túbulo proximal incrementando la resorción de
sodio e inhibiendo la secreción de renina, y en el sistema nervioso en donde estimula la ingestión de agua y aumenta la
secreción de vasopresina. La degradación de la Ang II por aminopeptidasas lleva a la formación de la angiotensina III y
angiotensina IV (Ang III y Ang IV, respectivamente) cuya actividad biológica es poco conocida.
Figura #25. Sistema local
generador de Angiotensina II
(SLGAII).
El angiotensinógeno sintetizado a nivel tisular es cortado localmente por la renina tisular, generando angiotensina I, la
cual puede ser cortada por enzimas como la ECA 1 (enzima convertidora de angiotensina II tipo 1), y la quimasa para
formar angiotensina II. Además en los tejidos se puede generar angiotensina II directamente del angiotensinógeno por
medio de las enzimas elastasa, catepsina G y el activador tisular del plasminógeno
SÍNTESIS DE LA ALDOSTERONA
La aldosterona se sintetiza y libera en la zona glomerulosa de la corteza suprarrenal; su precursor es el colesterol.
El principal estímulo para la síntesis de la aldosterona es la AII, que activa los receptores AT1 que se expresan en una alta
proporción en la zona glomerular adrenal (fig. # ). El complejo AII-receptor AT1 estimula la fosfolipasa C que, a su vez,
hidroliza el fosfatidilinositol-4,5-bifosfato en inositol-1, 4,5-trifosfato (IP3) y diacilglicerol (DAG). El IP3 así sintetizado

24
interactúa con receptores específicos localizados en la membrana del retículo endoplásmico, y produce una liberación del
calcio allí almacenado hacia el citosol, mientras que el DAG permanece en la membrana, donde activa la proteincinasa C
(PKC). Ésta, a su vez, activa las diversas enzimas, como la CYP11B2, que convierte la corticosterona en aldosterona. El
aumento de la volemia o de la ingesta de Na+ aumenta la presión arterial renal, lo que disminuye la secreción de renina y
AII; como consecuencia, disminuye la retención de Na+ y agua, se restablece la volemia y desaparece el estímulo que
inducía la reducción de la secreción de renina. La AII no sólo estimula la secreción de aldosterona, sino que ejerce un
efecto trófico en la zona glomerular.
Otros estímulos que inducen la síntesis de aldosterona son: una dieta pobre en Na+ (que aumenta la liberación de renina
y AII), el óxido nítrico, la endotelina-1, la noradrenalina, la serotonina, la vasopresina, el factor estimulador de la
aldosterona (una glucoproteína de origen hipofisario), la hormona lipolítica y la hormona estimulante de melanocitos (fig.
2). Por el contrario, la secreción de aldosterona es inhibida por la somatostatina, la heparina, los péptidos natriuréticos
auriculares (hay receptores para ellos en la zona glomerular) y la dopamina (inhibe la respuesta a la AII, pero no modifica
la síntesis basal de aldosterona).
MECANISMOS DE ACCIÓN DE LA ALDOSTERONA
El mecanismo clásico de acción de la aldosterona es su unión a receptores específicos intracitoplasmáticos, los RM. El RM
también se denomina receptor glucocorticoideo tipo I, ya que presenta la misma afinidad por los glucocorticoides que por
los mineralocorticoides.
Los RM tienen una distribución muy amplia. En tejido epitelial los podemos encontrar en el túbulo distal y colector del
riñón, en las glándulas sudoríparas y salivales, y en la mucosa intestinal (en particular en el colon). Clásicamente, el interés
se ha centrado en los efectos de la aldosterona sobre el tejido epitelial, donde promueve la reabsorción de Na+ y agua y
la eliminación de K+. Sin embargo, hoy día sabemos que la aldosterona produce importantes efectos tras interaccionar
con los RM localizados en el cerebro (mayoritariamente en las neuronas límbicas [hipocampo y septo]), los vasos
sanguíneos y las células cardiacas (miocitos, fibroblastos, monocitos).
El modelo clásico de acción de la aldosterona incluye los efectos que requieren la modulación génica, con la consiguiente
síntesis de proteínas (fig. 3) y los efectos que se producen a través de modificaciones en la transcripción (interferencia o
sinergia), que están mediados por la interacción de proteínas. Estos efectos no son inmediatos, sino que debe transcurrir
un tiempo de latencia (2-6 h) que es mayor para la síntesis de proteínas que para las modificaciones postranscripcionales.
En la modulación génica, el RM es un factor de transcripción activado por ligando, que se une a un elemento con capacidad
de respuesta para los mineralocorticoides (fig. 3). La unión de la aldosterona a sus receptores forma un complejo hormona-
receptor que se transloca al núcleo, donde interactúa con regiones específicas del ADN localizadas en la región promotora
(denominados elementos de respuesta a mineralocorticoides). Ello da lugar a la activación de la transcripción de diversos
genes, que conlleva la estimulación o supresión de la síntesis del ARNm, que codifica las proteínas causantes de las
acciones fisiológicas de la aldosterona. Como consecuencia de la activación de diversos genes (los genes más conocidos
regulados por la aldosterona son los que codifican para el transportador sodio: cloro (TSC), subunidad alfa del canal de
sodio (ENaC), canal epitelial de potasio (ROMK) y ATPasa sodio–potasio localizados en el túbulo distal y en el túbulo
colector.).La aldosterona aumenta tanto la expresión como la probabilidad de apertura de los canales de Na+ (sensibles a
amilorida, ENaC) y K+ en la membrana luminal y estimula la ATPasa-Na+-K+ en la membrana basolateral y la actividad
mitocondrial, con el consiguiente incremento en la producción de ATP. El aumento en la expresión y el número de canales
de Na+ en estado abierto facilita la reabsorción tubular de Na+ y el aumento de la actividad y la expresión de la ATP-asa
Na+/K+, así como su incorporación a la membrana basolateral facilita el paso de este Na+ hacia la circulación sistémica.
Este incremento de la reabsorción de Na+ aumenta la negatividad en la luz tubular y facilita la eliminación urinaria de K+ e
H+, y la excreción de hidrogeniones tiene lugar, fundamentalmente, en las células intercalares. Tanto el agua como el
Cl- siguen el flujo de entrada de Na+, si bien el Cl- pasa a través de la monocapa celular.
Otros efectores de la aldosterona son el intercambiador luminal Na+/H+ (NHE3), localizado en la región proximal del colon,
y el cotransportador Na+/Cl- (NCC) del túbulo renal distal. El aumento en la actividad del NHE3 y del NCC se traduce en un

25
incremento de la reabsorción de Na+ en el colon y el riñón, en respuesta a una reducción de la volemia; Este efecto no es
inmediato y tarda más de 45 minutos, alcanzando el efecto máximo después de varias horas.
Figura #26 mecanismo de acción de la aldosterona.
En líneas celulares de leucocitos mononucleares humanos, células del músculo liso vascular y cardiomiocitos, se ha
observado que la aldosterona puede producir acciones rápidas (en segundos) que se caracterizan por aumento en los
niveles de trifosfato inositol (IP3) y calcio intracelular, así como disminución de la actividad de la proteína cinasa C (PKC) y
la activación de la bomba Na+K+/AT pasa, por lo que se ha propuesto que la aldosterona ejerce efectos directos sin
modificar la trascripción de genes, lo que se ha denominado "efectos no genómicos" de la aldosterona, que parecen ser
mediados por receptores de membrana aún no identificados.
Se han identificado algunas vías de señalización que intervienen en las acciones no genómicas de la aldosterona. Entre
ellas destacan:
a) incremento en los valores de IP3 y de DAG.
b) un aumento en la concentración intracelular de Ca2+ inducida por el IP3 tras interactuar con sus receptores
localizados en la superficie del retículo endoplásmico
c) la activación de la proteincinasa A, secundaria al aumento en los valores intracitoplasmáticos de AMPc
d) un aumento de la entrada de Na+ en la pared vascular a través de la activación del intercambiador Na+-H+
e) la activación de diversas cinasas, como las activadas por mitógenos (MAPK) y la Src
NOTA : Se conoce que los glucocorticoides y mineralocorticoides tienen la misma afinidad por los receptores de
aldosterona, además de que los primeros son más abundantes que los segundos, por lo que la especificidad para que la
aldosterona se una a su receptor es mediada por la presencia de la enzima 11β–deshidrogenasa hidroesteroidea
(11βHSD2), que degrada a los glucocorticoides permitiendo que sólo la aldosterona se una a su receptor; por lo tanto, la
presencia de esta enzima es esencial para que la aldosterona ejerza sus efectos. En el tejido renal, esta enzima se
encuentra principalmente en el epitelio del túbulo distal y colector, pero también se ha observado en el epitelio y
endotelio glomerular. Por otra parte, estudios recientes muestran que la inhibición selectiva de la 11βHSD2 induce

26
sobrerregulación de receptores de angiotensina y modificación del tono vascular. Estas observaciones, junto con la
presencia de la sintasa de aldosterona en diferentes tejidos, sugieren que ésta ejerce acciones locales en diversos órganos
independientes de su acción clásica conocida.
Sistema multiplicador contracorriente
Los riñones pueden producir orina hipoosmótica, isoosmótica o hiperosmótica. La producción de orina hipoosmótica es
un proceso comprensible: los túbulos (en particular la rama gruesa ascendente del asa de Henle) resorben hasta cierto
punto más solutos que agua y el líquido diluido que queda en la luz se excreta. La producción de orina hiperosmótica
también es directa porque la resorción de agua desde la luz hacia el intersticio hiperosmótico concentra ese líquido
luminal y deja una orina concentrada para que se excrete. El asunto es saber lo que los riñones hacen para generar un
intersticio medular hiperosmótico. No sólo el intersticio medular es hiperosmótico, sino que además existe un gradiente
de osmolalidad que se incrementa desde el valor casi isoosmótico a nivel del borde corticomedular hasta un máximo que
excede 1 000 mosm/kg a nivel de la papila. (El valor máximo depende de ciertas condiciones; es el más alto durante los
periodos de deshidratación y sólo es de la mitad del observado durante la hidratación excesiva.) Ciertos aspectos del modo
en que los riñones generan un gradiente osmótico medular aún siguen sin aclararse. Sin embargo, los aspectos esenciales
se conocen bien y a partir de ahora la descripción se enfoca en ellos.
Los principales componentes del sistema que producen el gradiente osmótico medular son: 1) transporte activo de NaCl
por la rama gruesa ascendente desde la luz de la nefrona hacia el intersticio,
2) distribución extraordinaria de los vasos sanguíneos en la médula con los componentes descendentes en aposición
íntima contra los componentes ascendentes y
3) recirculación de la urea entre los conductos colectores medulares y las porciones profundas de las asas de Henle
Las acciones de la rama gruesa ascendente son las que se comprenden con más facilidad. En la unión entre las porciones
interna y externa de la médula, las ramas ascendentes de todas las asas de Henle, ya sean largas o cortas, se vuelven hacia
las regiones gruesas y permanecen con este espesor durante toda su trayectoria hasta que alcanzan las cápsulas de
Bowman originales de las que surgieron en la corteza. Conforme retiran solutos sin agua desde el líquido luminal y lo
diluyen, vierten de manera simultánea estos solutos también sin agua hacia el intersticio circundante (es decir, tienden a
concentrar el líquido intersticial). Esta acción de la rama gruesa ascendente es crucial. Si el transporte por la rama gruesa
ascendente se inhibe (p. ej., mediante diuréticos de asa que bloquean el simportador de Na-K-2 Cl), el líquido contenido
en la luz no se diluye y no ocurre concentración intersticial, por lo que la orina se vuelve isoosmótica. En las porciones de
la rama gruesa ascendente que se encuentran en la corteza, el soluto resorbido simplemente se mezcla con el material
que los túbulos contorneados principales cercanos resorbieron. Como la corteza contiene abundantes capilares
peritubulares, el material resorbido pasa de inmediato hacia los vasos sanguíneos y retorna a la circulación general. No
obstante, el flujo de sangre es mucho más bajo en la médula y circula por la distribución paralela.
El término flujo sanguíneo bajo significa que pueden acumularse solutos en el intersticio medular para producir una
osmolalidad mucho más alta que la de la sangre que le llega. (Si no hubiera flujo de sangre, en teoría, podrían acumularse
solutos sin límite, pero el flujo sanguíneo medular, aunque bajo, es finito). El flujo sanguíneo bajo no crea la
hiperosmolalidad sino que más bien la preserva. Otro factor vascular mayor es la distribución física de los vasos rectos
descendentes y ascendentes que corren en paralelo muy cerca entre sí.
Las propiedades específicas de permeabilidad de los vasos medulares y el contenido osmótico preciso del plasma en
diversas regiones aún son inciertos, pero, como otros lechos capilares, está claro que solutos y agua pueden entrar y salir
de los vasos rectos. El plasma contenido en su interior intercambia material suficiente con el intersticio para que la
osmolalidad plasmática por lo menos se aproxime a la de los alrededores; en otras palabras, el plasma se vuelve
hiperosmótico conforme circula por la profundidad de la médula. Si los vasos sanguíneos, que ingresan a la médula por la
unión corticomedular, la abandonaran por la papila (es decir, sólo corrieran por ella en línea recta), removerían un líquido
muy hiperosmótico y tenderían a eliminar la hiperosmolalidad del intersticio. Sin embargo, en vez de dejar la médula en

27
la punta, los vasos rectos cambian su trayectoria y vuelven a la unión corticomedular. Conforme el plasma hiperosmótico
fluye hacia arriba, tiende una vez más a equilibrarse con el intersticio circundante cuya osmolalidad está decreciendo en
estos momentos. Del mismo modo que el plasma se vuelve cada vez más hiperosmótico en su camino hacia abajo, ahora
se torna menos hiperosmótico y se acerca a un valor isoosmótico conforme fluye hacia arriba.
El flujo de sangre por vasos paralelos en direcciones opuestas y la capacidad de los vasos para equilibrar al menos en parte
su contenido con el del intersticio circundante se denominan sistema de intercambio a contracorriente y es un
componente importante del gradiente osmótico medular. Esta distribución a contracorriente no puede generar por sí
misma el gradiente osmótico, pero es crucial para preservarlo.
El tercer elemento del sistema es la recirculación de urea. La urea (concentración plasmática típica => 5 mmol/L) se filtra
con libertad y cerca de la mitad se resorbe en el tabulo proximal. Se secreta en el asa de Henle (regiones delgadas) con
restauración esencial de la urea tubular hasta montar la carga filtrada. Desde aquí hasta los conductos colectores
medulares internos su transporte es escaso, de modo que cualquier cantidad de urea que llegue a la rama gruesa
ascendente permanece allí al principio de los conductos colectores medulares internos. Como casi toda el agua se resorbió
para este momento (por los conductos colectores corticales y medulares externos), la concentración luminal de urea se
incrementa hasta cerca de 50 veces su valor plasmático (500 mmol/L o más). Algo de urea se resorbe en los conductos
colectores medulares internos mediante uni-portadores especializados de ésta.
Puesto que el flujo sanguíneo en esta región es bajo, la urea resorbida eleva la concentración intersticial cercana a la de
la luz (p. ej., 500 mmol/L o más según las condiciones existentes). De manera característica la mitad de la carga filtrada se
queda en la luz y se excreta. Si la concentración de urea del líquido intersticial es de 500 mmol/L, la osmolalidad intersticial
debe ser de por lo menos 500 mosm/kg pero, desde luego, es mucho más alta a causa de una contribución osmótica mayor
del cloruro de sodio.
Por lo general, la urea constituye cerca de la mitad de la osmolalidad medular y el cloruro de sodio la otra mitad. Conforme
la osmolalidad medular aumenta y disminuye con las condiciones cambiantes. Las concentraciones de ambos
componentes se elevan y descienden. Por ahora el aspecto clave consiste en que, mediante la recirculación de la urea de
nuevo hacia el intersticio, ésta contribuye en gran medida a la hiperosmolalidad de la médula y permite que los riñones
excreten orina hiperosmótica. La importancia de la urea para generar el gradiente osmótico medular se pone de relieve
en el caso de la ingestión deficiente de proteínas, cuya consecuencia es una producción metabólica muy reducida de urea.
En estas condiciones la capacidad de los riñones para producir orina muy concentrada se trastorna.
La magnitud del gradiente osmótico medular (en realidad la osmolalidad máxima encontrada en la parte interna de la
médula) varía de acuerdo con los estados de hidratación. La ADH, además de elevar la permeabilidad al agua en los
conductos colectores corticales y medulares, incrementa también su permeabilidad a la urea al estimular una isoforma
específica sensible a la ADH de los uniportadores de urea pero sólo en los conductos colectores medulares internos.
Considérese la forma en que esto afecta el gradiente osmótico medular. La tasa de filtración glomerular (TFG) es baja en
cierto grado y las concentraciones de ADH son altas cuando una persona está deshidratada. La extracción de agua en el
conducto colector cortical remueve la mayor parte de agua de la luz (y la vuelve isoosmótica con el intersticio cortical).
Luego, conforme el volumen restante pero muy reducido fluye por la médula con osmolalidad elevada, se produce
concentración ulterior. La mayor permeabilidad a la urea propiciada por la ADH ayuda mucho a generar el gradiente
osmótico medular al permitir la recirculación de este metabolito. ¿Qué ocurre en los estados de sobrehidratación, como
después de un concurso de ingestión de agua? Las concentraciones de ADH son bajas en estos casos. La TFG es elevada.
En los conductos colectores corticales sólo se resorbe una pequeña cantidad del líquido tubular que entra en ellos y la
urea tubular no se concentra de manera importante. Un gran volumen de líquido muy diluido con una concentración
odesta de urea se libera hacia los conductos colectores medulares internos. En contraste con los conductos colectores
corticales y medulares externos, que son casi impermeables al agua en ausencia de ADH, el conducto colector medular
interno tiene una permeabilidad finita al agua en ausencia de esta hormona. Aunque esta permeabilidad al agua no es
grande, la fuerza osmótica impulsora es gigantesca, por lo que se resorben cantidades sustanciales de agua. (Sin embargo,

28
no se resorbe aún más y por tanto el volumen urinario todavía es muy grande.) No se resorbe mucha urea; de hecho al
inicio puede secretarse porque su concentración luminal es más baja que la del intersticio medular. El resultado de la
resorción de agua y la resorción baja (o nula) de urea consiste en que la médula interna se "diluye" en parte (es decir, la
concentración de urea y la osmolalidad total del intersticio medular disminuyen con el paso del tiempo). La osmolalidad
decrece hasta cerca de la mitad de su valor (a 500 a 600 mosm/kg) durante la deshidratación máxima. Por este motivo la
sobrehidratación durante varios días antes de una actividad física esforzada (p. ej., carrera de maratón) que se acompaña
de pérdida de agua en forma de sudor puede ser contraproducente, porque el riñón será incapaz de conservar el agua en
la extensión en que podría hacerlo si el intersticio medular estuviera concentrado con normalidad.
Figura 27. Control renal del agua en los estados de antidiuresis máxima
(A) y diuresis máxima (B). Los valores de la derecha indican la osmolaridad intersticial, en tanto que los situados dentro de los túbulos indican la osmolaridad luminal. Las flechas señalan los sitios de resorción de agua. Tanto en la antidiuresis como en la diuresis, la mayor parte (65%) del agua filtrada se resorbe en el túbulo proximal y otro 10% en la rama descendente del asa de Henle. La resorción relativamente más grande de solutos por el asa produce de manera global un líquido luminal muy diluido en el túbulo distal (110 mosm). Durante la antidiuresis, las acciones de la hormona antidiurética permiten la resorción ulterior de agua en los túbulos colectores cortical y medular, lo que resulta en un líquido final muy hiperosmótico (1 200 mosm). Durante la diuresis no se produce resorción de agua en el túbulo colector cortical, pero ocurre un poco en el túbulo colector medular interno. La resorción sostenida de solutos reduce el contenido de éstos en un grado aún mayor que el contenido de agua y la orina final es muy diluida (70 mosm). En
los vasos rectos paralelos hay un intercambio considerable tanto de solutos como de agua, de modo que la osmolaridad plasmática y la concentración de solutos se equilibran con el intersticio circundante. Los vasos rectos remueven los solutos y el agua resorbidos en la médula. Como siempre ocurre cierta resorción neta de volumen en la médula inclusive en los estados de diuresis, el flujo de plasma de los vasos rectos que sale de la médula excede siempre el flujo de plasma que ingresa en ella.

29
Bibliografia
http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0034-83762005000200007 revisada el 21 de nov. 2015
http://www.facmed.unam.mx/publicaciones/ampb/numeros/2006/02/f_55_AngiotensinaII.pdf revisada el 21 de nov. 2015
http://www.revespcardiol.org/es/mecanismo-accion-eplerenona/articulo/13089615/ revisada el 21 de nov. 2015
Martínez Maldonado (1993), tratado de nefrología, Ediciones Norma, 2da edición, Madrid, España, pp.68, 75.
http://www.revbiomed.uady.mx/pdf/rb152615.pdf revisada el 28 de noviembre 2105 12:47pm.
http://carcin.oxfordjournals.org/content/30/3/377.full revisada el 28 de noviembre 2105 12:47pm.
http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0016-38132004000100012 revisada el 21 de nov. 2015
http://www.revistanefrologia.com/es-publicacion-nefrologia-articulo-fisiologia-molecular-del-mecanismo-concentracion-urinario-papel-las-aquaporinas-renales-X0211699500035672 revisada el 21 de nov. 2015
Sherwood Lauralee (2011), Fisiología humana, editorial CENGAGE Learning, séptima edición, México, D.F, pp.526-544.
Ganon, (2012), Fisiología médica, 24ª edición, editorial Mc Graw Hill, México, D.F, pp. 353.
http://digital.csic.es/bitstream/10261/69828/1/Quimiorreceptores.pdf
http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/steinera/parte04/02j.html
Guyton y Hall, Tratado de Fisiología médica, Ed. Elsevier, 11va. Edición, 2011, pp. 303-340,379-3

30