ENLACE QUÍMICO · Web viewLa geometría de cada átomo de carbono es triangular plana. Sin embargo...
Click here to load reader
Transcript of ENLACE QUÍMICO · Web viewLa geometría de cada átomo de carbono es triangular plana. Sin embargo...

QUÍMICA 2º BACHILLERATO Enlace Químico - 1 -
ENLACE QUÍMICOLa mayor parte de las especies químicas que encontramos en la Naturaleza no son átomos
aislados, sino que la mayoría de los elementos se presentan ligados a otros formando estructuras más estables, es decir que poseen menor energía que la que tenían sus átomos por separado. Si los átomos que se unen son iguales la sustancia resultante es un elemento, en caso contrario se trataría de un compuesto.
Las fuerzas que mantienen unidos estos átomos en los distintos agregados se denominan enlaces químicos. También estudiaremos las fuerzas que se ejercen las moléculas entre sí y que son las responsables de muchas de las propiedades físicas de las sustancias (fuerzas intermoleculares)
Denominaremos enlace químico al conjunto de fuerzas que mantienen unidos los iones, átomos o moléculas formando los distintos agregados químicos.
Las propiedades físicas y químicas que presenten las distintas sustancias dependerán de la naturaleza del enlace con el que se encuentren unidos los átomos de sus elementos. En particular, las reacciones químicas que presentan las sustancias son el resultado de la ruptura y formación de enlaces entres sus átomos.
Así mismo, cualquier teoría que estudie los enlaces químicos deberá poder explicar aspectos tales como la proporción en la que se unen los átomos, las geometrías de las moléculas resultantes y la energía del enlace producido.
Existen tres modelos extremos de enlace químico: el enlace iónico el enlace covalente el enlace metálico
En realidad las propiedades que presentan la mayoría de los compuestos químicos necesitan de varios modelos de enlace para una descripción adecuada de las mismas.
Si, desde el punto de vista energético en un enlace químico, se produce una disminución de energía con respecto a las sustancias aisladas, desde el punto de vista electrónico esta situación de mayor estabilidad se manifiesta en una tendencia a adquirir la configuración de gas noble.
Estos elementos, cuya última capa se encuentra completa con una estructura ns2 np6 (salvo el helio que posee 1s2), son excepcionalmente estables presentando escasa tendencia a combinarse, lo que llevó a Kossel y Lewis a proponer la llamada regla del octeto que consistía en suponer que los átomos de los diversos elementos se unen tratando de alcanzar configuraciones de gas noble.
Según el valor relativo de las electronegatividades de los átomos que se enlazan se dará un tipo de enlace u otro.
EN1.- Indica el tipo de enlace que se establecerá entre: a) O y N, b) Mg y S, c) F y Se y d) Ca y Br
EN2 .- Los números atómicos de tres elementos son A (Z=15), B (Z=20) y C (Z=35). Justifica qué tipo de enlace se dará entre: a) A y C y b) B y C
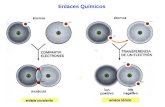
ENLACE IÓNICODepartamento de Física y Química I.E.S. GALLICUM – Zuera -
Electronegatividad Tipo enlace Se produce entre ... EjemploMuy diferente Iónico Metal y no metal NaClAltas y semejantes Covalente No metales entre sí H2OBajas y semejantes Metálico Metales entre sí Hierro

QUÍMICA 2º BACHILLERATO Enlace Químico - 2 -
En la anterior unidad vimos que los metales presentan bajos valores de energía de ionización y de electronegatividad; tienen tendencia a ceder electrones. Por el contrario los no metales con valores de electronegatividad elevados tienen tendencia a captar electrones.
Cuando se unen un elemento metálico y otro no metálico, el primero es capaz de ceder electrones al segundo, de esta forma ambos adquirirán configuración de gas noble convirtiéndose, el metal en un ion positivo y el no metal en uno negativo. La atracción electrostática que se producirá entre iones de distinta carga será la responsable del enlace que se originará entre estas sustancias.
Veamos como se produce un enlace iónico:
Formación de iones. Se produce una transferencia de electrones entre el metal y el no metal. Este paso es desfavorable desde el punto de vista energético.
Na (1s2 2s2 2p6 3s1) - 1 e- Na+ (1s2 2s2 2p6) EI = 495 kJ/mol
Cl (1s2 2s2 2p6 3s2 3p5) + 1 e- Cl- (1s2 2s2 2p6 3s23p6) AE = - 349 kJ/mol
Si el proceso descrito es deficitario en energía ¿cuál es la causa de que se forme el NaCl (s)?
Formación del cristal iónico. Una vez constituidos los iones se organizan de modo que sean máximas las atracciones entre los iones de carga opuesta y se minimicen las repulsiones entre los de igual carga. Se forma una red cristalina tridimensional de aniones y cationes, colocados en posiciones fijas a una distancia que se corresponde con la suma de los radios iónicos (
). Esta circunstancia permite que un ion interaccione con los demás alcanzándose una situación de máxima estabilidad. En este proceso se libera la llamada energía de red (U) que compensa el defecto energético de la formación de iones.
Se define energía de red (U) como la cantidad de energía liberada cuando se forma un mol de un compuesto iónico sólido a partir de sus iones constitutivos en estado gaseoso.
En muchos casos el valor de esta magnitud (U) no se puede medir directamente, pero puede hacerse indirectamente mediante el denominado ciclo de Born-Haber. Se basa en la hipótesis de que el balance energético ligado a un proceso es el mismo se desarrolle en una sola etapa o en una serie de fases parciales (Ley de Hess)
Veamos como ejemplo el caso del cloruro de sodio (NaCl):(Como veremos en la Unidad de Termoquímica, las energías absorbidas por un sistema se consideran
positivas, mientras que las que cede negativas)
A. Proceso directo de formación del NaCl (s) a partir de sus elementos constituyentes en estado estándar (más estable)
ΔHF (Variación de Entalpía de Formación NaCl) = ‒ 441,1 kJ/mol (Energía intercambiada, a presión constante, en la formación de un mol de un compuesto a partir de los elementos
que lo integran en su estado más estable)
B. Formación del NaCl (s) a través de un proceso en etapas:
i) Formación de los átomos en estado gaseoso
- ΔHS (Energía de Sublimación del sodio)=+107,8 kJ/mol
- ΔHD (E. de Disociación del cloro gas) = +242,6 kJ/mol
ii) Formación de los iones en estado gaseoso:
- EI (Energía de Ionización del sodio) = +495,4 kJ/mol
- AE (Afinidad Electrónica del cloro) = ‒348,8 kJ/mol
iii) Formación de la red cristalina U (Energía de Red NaCl) = ¿?Departamento de Física y Química I.E.S. GALLICUM – Zuera -
Cl (g)
Na+ (g)
++
++
+
++++ +
ΔHF
½ ΔHD
½ Cl2Na (s)
+
ΔHS S
AE
EI UNa (g)
Cl‒ (g)
-- -
----
-
NaCl (s)
- - --- - --- - ---
+++
+++- - --- - --- - ---
+++
+++- - --- - --- - ---
+++
+++

QUÍMICA 2º BACHILLERATO Enlace Químico - 3 -
Teniendo en cuenta el principio de conservación de la energía, en este ciclo se cumplirá que:
Δ HF = ΔHS + ½ ΔHD + AE + EI + U
‒ 411,1 kJ/mol = 107,8 kJ/mol + ½ (242,6) kJ/mol + (‒ 348,8) kJ/mol + 495,4 kJ/mol + U
U = ‒ 786,8 kJ/mol
En la mayoría de los compuestos iónicos la energía de red (U) tiene un valor negativo elevado que compensa el balance energético desfavorable de las restantes etapas. (Tabla I)
Ejercicio resuelto 1.- Calcula la energía de red (U) del óxido de potasio a partir de los siguientes datos:ΔHDisociación(O2) = 494 kJ/mol ΔHSublimación(K) = 90 kJ/mol ΔHFormación(K2O) = – 562,6 kJ/molEI(K) = 418,4 kJ/mol 1ªAE (O) = – 141 kJ/mol 2ªAE (O) = 844 kJ/mol
A) Proceso directo:2K (s) + ½ O2 (g) → K2O (s) ΔHFormación(K2O) = – 562,6 kJ/mol B) Proceso indirecto:1) Formación de los átomos en estado gaseoso:
2 K(s) → 2 K(g) 2.ΔHSublimación(K) = 2.(+90 kJ/mol) ½ O2 (g) → O(g) ½ ΔHDisociación(O2) = ½ (+494 kJ/mol)
2) Formación de los iones en estado gaseoso: 2 K (g) → 2 K+ (g) 2.EI (K) = 2.(+418,4 kJ/mol)O (g) → O- (g) 1ª AE (O) = – 141 kJ/molO- (g) → O2- (g) 2ª AE (O) = + 844 kJ/mol
3) Formación de la red iónica del K2O (U) 2 K+ (g) + O2‒ (g) → K2O (s) U?
Teniendo en cuenta el principio de conservación de la energíaΔHFormación(K2O) = 2.ΔHSublimación(K) + ½ ΔHDisociación(O2) + 2.EI (K) + 1ª AE (O) + 2ª AE (O) + U
‒ 562,6 kJ/mol = 2.(90 kJ/mol) + ½ ( 494 kJ/mol) + 2.(+418,4 kJ/mol) + (– 141 kJ/mol) + 844 kJ/mol + UU = – 2529,4 kJ/mol
EN3.- A partir de su configuración electrónica determina qué ion tenderán a formar los siguientes elementos: Sr, Al, F y Cu
EN4.- Representa el ciclo de Born-Haber para el CaBr2 y, a partir de los datos que se te proporcionan en la tabla adjunta, determina el calor de sublimación del calcio. Sol: 120,7 kJ/mol
El cálculo teórico de la energía de red (U) puede hacerse mediante la ecuación de Born-Landé:
Los valores de A y n dependen del tipo de red que se forme.
Si nos fijamos en la anterior ecuación los valores que se obtendrán de U se encontrarán influenciados por el tamaño de los iones y por su carga.
Al disminuir el radio de los distintos iones, menor será al distancia entre ellos y mayor su atracción, lo que se traducirá en un aumento en los valores de la energía de red.
Cuanto mayor sea la carga de los iones mayor será la intensidad con la que interactuarán y, por consiguiente, mayor será su energía de red. Este factor es más determinante que el anterior a la hora de evaluar variaciones en los valores de U de diversos compuestos iónicos.
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
ΔHFormación (CaBr2 (s)) - 675 kJ/mol 2ª EI (Ca (g)) 1145,3 kJ/molΔHVaporización (Br2 (l)) 315 kJ/mol 1ª AE (Br (g)) - 324 kJ/molΔHDisociación (Br2 (g)) 193 kJ/mol U (CaBr2 (s)) - 2391 kJ/mol1ª EI (Ca (g)) 590 kJ/mol ΔHSublimación (Ca (s)) ¿?
2 K (s) + ½ O2 (g)
2 K (g) + ½ O2 (g)
2 K (g) + O (g)
2 K+ (g) + O (g)
2 K+ (g) + O– (g)
2 K+ (g) + O2– (g)
K2O (s)EN
ERG
ÍAΔHF (K2O (s))
U (K2O)
2.ΔHS 2 K (s) → 2 K (g)
2.EI 2K (g) → 2K+ (g)
O (g) → O2– (g) 2ª.AE
O (g) → O– (g) 1ªAE
½ ΔHS ½ O2 (g) → O (g) (g)

Centrada en las caras Centrada en el cuerpo
Tabla 2. TIPOS DE REDES IÓNICASCompuestosÍ. Coordinación
Anión / CatiónEstructura de lared iónicaNaCl, NaBr6 / 6Centrada en las carasCsCl,
Cs Br8 / 8Centrada en el cuerpoZnS, BS4 / 4TetraédricaTiO23 / 6TriangularCaF24 / 8Tetraédrica
QUÍMICA 2º BACHILLERATO Enlace Químico - 4 -
Cuanto más negativa sea U más estable será la red iónica y mayores serán las fuerzas de atracción entre los iones que forman el compuesto iónico.
Si las cargas de los iones tienen una gran influencia en la energía de red ¿por qué la red iónica del cloruro de sodio se encuentra formada por iones Na+ y Cl- y no por Na2+ y Cl2-? Pues porque la formación de un ion Na+ a partir del átomo de sodio requiere una aportación de
energía de 495,4 kJ/mol e implica la eliminación del único electrón de la capa de valencia mientras que la formación del Na2+ requeriría un aporte de 5060 kJ/mol (1ªEI + 2ªEI) puesto que implica la eliminación de un segundo electrón situado en una capa interna. Este valor tan elevado de energía no es compensado por la energía de red del compuesto formado.
Como se observa en la tabla I los valores (absolutos) de U son más elevados en el caso de los óxidos metálicos que en los halogenuros y entre éstos los mayores valores de U se corresponden con los menores tamaños de los iones correspondientes.
Redes iónicas En los compuestos iónicos los distintos iones se ordenan en estructuras tridimensionales
compactas, denominadas redes iónicas, en las que cada ion se encuentra rodeado del máximo número de iones del signo contrario posible. Se puede distinguir es ellas una forma básica, llamada celdilla unidad, que se repite indefinidamente en todo el cristal
Se denomina índice de coordinación al número de iones del signo contrario que rodean un ion determinado en una red iónica.
El tipo de red en que cristalizan los diversos compuestos iónicos viene determinada por el índice de coordinación de cada ion el cual depende de:
los tamaños relativos de los iones y de las cargas de los mismos
En el NaCl cada ion Cl – podría rodearse de 12 iones Na +, pero como alrededor de cada Na+ sólo pueden colocare 6 iones Cl
– y en este compuesto el número de Na+ ha de ser igual al de Cl – (se ha de mantener la neutralidad eléctrica del compuesto), se obtiene como resultado una red iónica en la que cada ion se encuentra en el centro de un tetraedro
en el que en cada uno de los 6 vértices se sitúan los iones del signo contrario, dando lugar a una red cúbica centrada en las caras.
En el caso del CsCl cada ion es rodeado de 8 del signo contrario por que resulta una red en la que cada ion ocupa el centro de un cubo en cuyos vértices se encuentran los iones del signo opuesto dando como resultado una red centrada en el cuerpo
Si el compuesto está formado por iones de distinta carga, caso de la fluorita (CaF 2), el índice de coordinación del catión será el doble que el del anión de manera que se mantenga la neutralidad del compuesto; en este caso los índices de coordinación son 8 para el catión y 4 para el anión.
Como habrás podido suponer, en un compuesto iónico no existen verdaderas moléculas, ya que un cristal está formado por un elevadísimo número de iones de carga opuesta. En estos compuestos la fórmula sólo nos indica la proporción en la que se encuentran los distintos iones en la red iónica.
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
F Cl Br I O SLi 1046 861 818 759 Be 4523Na 929 787 751 702 Mg 3850 3406K 826 717 689 645 Ca 3511 3119Rb 790 692 665 629 Sr 3283 2975Cs 734 660 636 603 Ba 3115 2832
Tabla 1. ENERGÍAS RETICULARES (kJ/mol) DE ALGUNOS COMPUESTOS IÓNICOS

QUÍMICA 2º BACHILLERATO Enlace Químico - 5 -
Propiedades de los compuestos iónicos.Las propiedades de los compuestos iónicos están relacionadas con intensidad de las fuerzas
electrostáticas que mantienen unidos los iones en la red cristalina. Muchas de ellas (puntos de fusión y ebullición, solubilidad, dureza,…) están ligadas a los valores de las energías de red de estos compuestos
Puntos de fusión y ebullición. La mayoría de los compuestos iónicos son sólidos que poseen elevados puntos de fusión y ebullición. La intensa atracción entre los iones de distinto signo hace que sea necesario aportar mucha energía para romper la red cristalina (p.e. el NaCl funde a 801 ºC, el MgO a 2640 ºC). La presencia de iones en los compuestos fundidos y las atracciones que experimentan explica también, sus elevados puntos de ebullición. En general, cuanto mayor sea el valor de la energía de red de un compuesto, más elevados serán sus puntos de fusión y ebullición.
Dureza y fragilidad. La oposición de estos compuestos a ser rayados está relacionada con la intensidad de las fuerzas electrostáticas que hay que vencer (dureza). Sin embargo, ejerciendo una fuerza moderada sobre la red se puede provocar un desplazamiento de una capa de iones sobre su contigua consiguiendo que queden enfrentados iones del mismo signo; esta situación conlleva la aparición de repulsiones electrostáticas y la consiguiente ruptura de enlaces (fragilidad)
Solubilidad. Estos compuestos se disuelven, generalmente, en disolventes polares. Las moléculas del disolvente interaccionan con los iones situados en la superficie de la red cristalina del compuesto iónico. Si esta interacción es mayor que las atracciones que mantienen unidos los iones en la red iónica se producirá el desmoronamiento de la misma y los iones quedarán libres en el disolvente rodeados de sus moléculas.
Conductividad. En estado sólido, estos compuestos, y debido a las posiciones fijas que mantienen los iones en la red, no son conductores de la electricidad. Sin embargo sí lo son cuando se encuentran fundidos o disueltos puesto que los iones que formaban la red iónica quedan libres con la posibilidad de poder desplazarse.
EN5 .- Clasifica los compuestos de cada una de las dos series siguientes en orden creciente de su energía de red: a) KCl, NaF y KI y b) CaO, KCl y SrS.
EN6.- Ordena los siguientes compuestos iónicos NaCl, MgO y LiF según el valor creciente de: a) su energía de red, b) su punto de fusión y c) su solubilidad.
ENLACE COVALENTELa gran mayoría de los compuestos químicos presentan unas propiedades físicas y químicas
muy diferentes de las presentadas por los compuestos iónicos. Son sustancias formadas por moléculas discretas, formadas, generalmente, por átomos de elementos no metálicos, que presentan unas geometrías definidas muy distintas a las redes cristalinas de los compuestos que acabamos de estudiar.
Las fuerzas que mantiene unidos los átomos son más intensas que las encontradas en los compuestos iónicos (en compuestos iónicos encontramos agrupaciones de átomos que siguen unidos cuando la sustancia se encuentra bien disuelta o bien fundida como es el caso de iones NO3
‒ , ClO4‒, SO4
2‒…)
Por tanto, es necesario introducir un nuevo modelo de enlace químico que explique estas y otras características presentes en este tipo de compuestos.
La figura muestra cómo varía la energía del sistema cuando se aproximan dos átomos.
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
+ + ++ + +
+ + +
+ + ++ + +
+ + +
F
++ +
+
+
++
+

Cl●●
●●
● ● Cl●●
●●
● ●
HH O●
●●●
QUÍMICA 2º BACHILLERATO Enlace Químico - 6 -
Cuando éstos se encuentran muy separados, no existe interacción entre ellos y la energía del sistema es prácticamente nula. Al acercarse, aparecen fuerzas de naturaleza electrostática entre los electrones de un átomo y el núcleo del otro provocando un desplazamiento de las nubes electrónicas hacia la región del espacio situada entre ambos núcleos, a la vez que una disminución de energía del sistema. Si se sigue disminuyendo la distancia predominarán las fuerzas de repulsión entre las dos nubes electrónicas y entre los núcleos de ambos átomos provocando un incremento de la energía que conlleva una desestabilización del sistema.
El desplazamiento de las nubes electrónicas a la zona internuclear, situación en la que los dos átomos comparten electrones, minimiza las repulsiones comentadas alcanzándose una situación de equilibrio y máxima estabilidad en la que la energía del sistema es mínima. Esta situación se consigue para una determinada distancia internuclear (r0) denominada distancia de enlace.
La formación del enlace va acompañada de un desprendimiento de energía denominada energía de enlace (E0), que hace que la molécula formada por los dos átomos sea más estable que ambos por separado.
Esta energía de enlace será la misma que la que se deberá aportar para romper el enlace formado.
Teoría de LewisG. Lewis (1875-1946) sugirió que cuando los átomos de los elementos no pueden alcanzar la
estructura electrónica de gas noble mediante la ganancia o pérdida de electrones (como ocurre en el enlace iónico) pueden hacerlo compartiéndolos. Se producirá entonces un enlace covalente. Este tipo de enlace se establece cuando se combinan elementos que poseen electronegatividades elevadas y semejantes (no metales)
Por ejemplo, la formación de la molécula de cloro (Cl2) puede explicarse por la unión de dos átomos de cloro que comparten un par de electrones formándose un enlace covalente entre ellos.
Podemos representar la situación haciendo uso de la notación Lewis que toma como base el símbolo del elemento rodeado de tantos “●” o “x” como electrones tenga en su capa de valencia (si hay menos de cuatro se colocan uno a cada lado del símbolo, si hay más lo harán formando parejas)
Cada uno de los átomos de cloro, que dispone de siete electrones en su capa de valencia, va a completar el octeto cuando se forma la molécula de Cl2, pues el par de electrones compartido pertenece simultáneamente a ambos átomos.
Se suele representara mediante un guión el enlace covalente formado entre dos átomos y mediante “●” o “x” los electrones no compartidos (electrones no enlazantes). En la molécula de cloro, cada átomo presenta cuatro pares de electrones uno compartido y los otros tres no compartidos.
Dependiendo del número de electrones que se precise, un átomo puede formar varios enlaces covalentes. En la molécula de agua, los dos átomos de hidrógeno están unidos al de oxígeno mediante enlaces covalentes formados por la compartición de un par de electrones cada uno; de esta forma el átomo de oxígeno, que forma dos enlaces covalentes, completa su capa de valencia con ocho electrones y cada uno de los de hidrógeno la suya con dos electrones:
En los ejemplos vistos, Cl2 y H2O, cada uno de los electrones del par que forma el enlace es aportado por cada uno de los átomos que se enlazan. Puede suceder que los dos electrones del
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
Cl●●
●●
● ●●Cl●
●●●
● ●●Cl●
● ●●●
●●+Cl● ●●
●●
●●
O● ●●
●
●●xH ++ xH
xH O●●
●
● ●●
xH
Ener
gía
Ee
rr0Distancia
internuclear→

FH
●●
● ●●●
FH
●●
● ●●●
SFH
●●
● ●
● ●
FH
●●
● ●
● ● FH
● ●●●● ●
FH
● ●●●● ●
Cl●●
● ●●●
P
Cl●● ● ●
●●
Cl●●
● ●
● ●Cl●●
● ●
● ●
Cl●● ● ●
●●
SF6 PCl5
BF3
BF●
● ●●
●●
F● ●● ●
●●
F ● ●
●●
●●
Oxígeno O2 Nitrógeno N2
=O●●
●●O●●
●●≡N●
●●●N
Orden de enlaceC-CC=CC≡CDistancia (Ǻ)1,541,341,20E. de enlace (kJ/mol)348612837
QUÍMICA 2º BACHILLERATO Enlace Químico - 7 -
par sea aportado solamente por uno de los átomos. Por ejemplo, la formación del ion amonio por reacción entre una molécula de amoniaco NH3 y un protón H+:
En este caso, el enlace covalente que se forma entre el amoniaco y el protón se realiza con el par de electrones no compartidos que el átomo de nitrógeno tenía en la molécula de amoniaco (una vez formado la carga positiva del H+ se dispersa por todo el sistema)
Este tipo de enlace se denomina enlace covalente coordinado o dativo; se suele representar mediante una flecha dirigida desde el átomo que aporta los electrones al que no lo hace. Una vez formado, el enlace covalente coordinado o dativo no se diferencia de los demás enlaces covalentes.
Cuando, en un enlace covalente, los átomos que lo forman comparten un par de electrones, decimos que están unidos mediante un enlace sencillo o simple. Pero es frecuente que, para completar su capa de valencia, los átomos implicados en un enlace compartan más de un par de electrones; cuando estos átomos comparten dos o tres pares de electrones se dice que forman enlaces
múltiples. Si comparten dos pares hablamos de enlace doble como, por ejemplo en la molécula de oxígeno O2, y si son tres los pares de electrones compartidos se tratará de un enlace triple, como en el caso de la molécula de nitrógeno N2.
La formación de enlaces múltiples confiere a las moléculas una estabilidad especial. A medida que aumenta el orden de enlace (sencillo, doble o triple) disminuye la distancia de enlace y aumenta la energía de enlace.
Se observa que, a medida que aumenta el orden de enlace lo hace la energía de enlace. El enlace triple es más estable que el doble y éste más que el sencillo; sin embargo la energía de enlace del triple y la del doble no son el triple y doble, respectivamente, de la energía de enlace de la del simple.
En las representaciones Lewis de iones deberemos considerar la carga que éste posea con el fin de añadir o eliminar electrones al sistema.
Los iones poliatómicos, que forman parte de los compuestos iónicos, son especies cargadas que contienen átomos unidos mediante enlaces covalentes. Por ejemplo, el KNO 3 es un compuesto iónico formado por los iones K+ y NO3
–; éste último ion, a su vez, se encuentra formado por tres átomos de oxígeno y uno de nitrógeno enlazados covalentemente.
EN7.- Indica la estructura Lewis de las siguiente moléculas: C2H6, NF3, CO2, C2H2, ClCN, H3PO4 y CH3COOH (en las moléculas poliatómicas el átomo central suele ser el elemento menos electronegativo)
EN8.- Deduce la representación Lewis de los iones: O2 ‒, H3O+, CN‒ y CO32 ‒
Excepciones a la regla del octetoLa mayor parte de los compuestos covalentes comparten electrones hasta adquirir ocho en su
capa de valencia, sin embargo la regla del octeto no justifica la formación de otros compuestos covalentes. En el caso de la molécula de hidrógeno, los átomos de este elemento completan su capa de valencia con tan sólo dos electrones.
Otros elementos comparten más electrones que los necesarios para adquirir la configuración de gas noble. Este comportamiento es habitual en los átomos de los elementos del tercer periodo y siguientes (estos
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
←
HHN
HH
+HHN
H
●●H+ +

QUÍMICA 2º BACHILLERATO Enlace Químico - 8 -
elementos disponen de orbitales d, con energías similares a las de los s y p de su mismo nivel, que pueden ser utilizados para la formación de los enlaces).
Por ejemplo, en las moléculas de hexafluoruro de azufre SF6 y pentacloruro de fósforo PCl5, los átomos centrales S y P tienen, respectivamente, 12 y 10 electrones en su capa de valencia
(octeto expandido)
También existen elementos del grupo 13, p.e. el boro y el aluminio, que tienden a formar enlaces covalentes sin lograr alcanzar la configuración de gas noble. En el trifluoruro de boro, el átomo del boro solo
tiene tres pares de electrones (octeto incompleto)
Por último existen algunas moléculas, p.e. las de NO y NO 2, que al contener un número impar de electrones nunca podrán cumplir la regla del octeto.
Se puede concluir que lo que determina que se forme un enlace entre dos átomos no es tanto el alcanzar la configuración de gas noble sino el hecho de compartir electrones
EN9.- De las siguientes moléculas CCl4, CO, SeCl6, BeH2 y BCl3 ¿cuáles tienen átomos que no cumplen la regla del octeto?
EN10.- Representa la estructura Lewis del SCl6 y del IF7
EN11.- Describe mediante las estructuras Lewis de las especies que participan, la reacción: AlCl3 + Cl ‒ → AlCl4‒
ResonanciaEn algunos casos las especies químicas pueden representarse por más de una estructura
Lewis, sin que ninguna de ellas describa adecuadamente sus características.
Para el ion nitrato (NO3–) se pueden obtener tres representaciones Lewis, en las que habrá
que considerar el electrón adicional por tratarse de un ion mononegativo, que difieren en la localización del doble enlace. Las experiencias han demostrado que los tres enlaces N – O tienen la misma longitud, por lo tanto el representar el ion nitrato mediante una sola estructura daría una imagen falsa de dicho ion. Ante la dificultad de encontrar una buena representación para esta especie, se utiliza una combinación de estructuras Lewis separadas por flechas con dos puntas.
Se considera que el ion es una mezcla de las tres estructuras. Cada una de las tres formas se denomina estructuras resonantes y la especie en cuestión es un híbrido de resonancia.
Dos estructuras de una molécula o un ion poliatómico son resonantes cuando difieren en la ordenación de sus electrones.
(Cada forma resonante se suele representar encerrada entre corchetes y si se trata de un ion su carga se indica como superíndice)
EN12.- Indica las estructuras resonantes que presentan las moléculas de O3 y SO3
En algunas moléculas o iones, las estructuras Lewis que más contribuyen al híbrido de resonancia no son las que cumplen la regla del octeto sino aquellas en los que los átomos presentan menores valores de Carga Formal (CF). La Carga Formal sobre un átomo es la diferencia entre los electrones de valencia de ese átomo libre y los que se le asignan cuando se encuentra combinado (la mitad de los que comparte y todos los que no)
CF = (nº e- valencia)átomo aislado – (nº e- sin compartir + ½ x nº e-
compartidos)molécula o ion
Observando la figura adjunta, en donde se indican las Cargas Formales sobre los átomos, se comprueba que las dos estructuras b) presentan menores valores y por tanto serán representaciones Lewis más adecuadas para los iones sulfato y fosfato.
Muchas de las propiedades de las sustancias dependen de su estructura interna.
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
O● ●
●●
NO
O● ●● ●
●●
NO
O
O O● ●
●●
NO● ●
● ●●●
O
Estructuras resonantes para el ion nitrato
–
-
–
-
–
-
-2 OO S O O
-1
-1 0
0
0
OO S O O
-1
-1 -1
-1
+21
-2a)
b)
Estructuras Lewis y cargas formalespara los iones
-3 OO P O O
-1
-1 0
0
-1
OO P O O
-1
-1 -1
-1
+11
-3a)
b)

QUÍMICA 2º BACHILLERATO Enlace Químico - 9 -
A diferencia del iónico, el enlace covalente es direccional; los átomos forman enlaces entre sí en determinadas direcciones. La geometría molecular viene determinada por la disposición de los átomos de una molécula en el espacio; esta disposición dependerá de los enlaces covalentes que forma cada átomo.
Aunque la teoría de Lewis permite conocer el número y tipo de enlace que presentan los átomos en una molécula, no nos proporciona información sobre la geometría de la misma. Ésta puede determinarse por medio de técnicas sofisticadas como la difracción de rayos X o de electrones, espectroscopia infrarroja,…; de este modo se pueden conocer distancias y ángulos de enlace entre los átomos que forman la especie estudiada (ángulo de enlace es el formado por dos enlaces que contienen un átomo en común)
Para comprender y predecir en qué direcciones se producen los enlaces covalentes y a partir de ahí, determinar la geometría de las moléculas con bastante precisión se utiliza el modelo o la Teoría de Repulsión entre los Pares de Electrones de la Capa de Valencia (TRPECV)
Teoría de Repulsión de los Electrones de la Capa de ValenciaLos pares de electrones de la capa de valencia del átomo central se sitúan en el espacio de tal
forma que queden lo más alejados entre ellos con el fin de que sean mínimas las repulsiones que se ejerzan. Esta situación se conseguirá cuando sean máximos los ángulos entre dos pares de electrones cualesquiera.
Esta teoría tiene en cuenta tanto los pares de electrones compartidos (enlazantes), que son los que forman el enlace covalente, como los no compartidos (no enlazantes), que, aunque no intervienen en los enlaces, ocupan un lugar en el espacio. Así, en la molécula de amoniaco, el nitrógeno queda rodeado por cuatro pares de electrones, tres de ellos enlazantes y uno no enlazante.
Para averiguar la geometría molecular utilizando la TRPECV:1.- Representamos la estructura Lewis de la especie.2.- Contabilizamos los pares de electrones alrededor del átomo central (los enlaces múltiples
se consideran como sencillos ya que constituyen una sola dirección de enlace)3.- Estudiamos la geometría que proporcione mayor alejamiento entre los pares electrónicos
contando con los pares no enlazantes (Geometría electrónica)4.- Vemos, si existen pares de electrones no enlazantes, las posibles modificaciones a la
Geometría Electrónica. Las mayores repulsiones se producen entre pares de electrones no enlazantes y las mínimas entre pares enlazantes.
5.- Obtendremos la Geometría Molecular sólo con los pares de electrones enlazantes.
● Ejemplo 1. Molécula de cloruro de berilio (BeCl2)
1.- Configuraciones electrónicas de los átomos implicados y estructura Lewis propuesta: Be: 1s2 2s2
Cl: 1s2 2s22p6 3s23p5
2.- Alrededor del átomo central, el de Be en este caso, se disponen dos pares de electrones. El átomo de Be ha formado dos enlaces covalentes con cada uno de los átomos de Cl.
3.- Los dos pares de electrones que rodean al Be se dispondrán en línea, de modo que se minimice las repulsiones entre ellos, dando lugar a una Geometría Electrónica lineal.
4.- No existen pares de electrones no enlazantes alrededor del átomo de Be
5.- Como los pares de electrones son compartidos, los átomos de cloro deberán colocarse de forma que el enlace Cl – Be – Cl sea de 180º, dando lugar a que la molécula de BeCl2 sea lineal.
● Ejemplo 2. Molécula de trifluoruro de boro (BF3)
1.- Configuraciones electrónicas y estructura Lewis:
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
Mayor repulsión Menor repulsión Par no enlazante – par no enlazante > Par enlazante – par no enlazante > Par enlazante – par enlazante
●●
●●Cl● ● ●
●●
●●Cl● ● ●Be ●
● ●●
●●Cl● ●
●●
●●Cl ● ●Be
+ +
BF●
● ●●
●●
F● ●● ●
●●
F ● ●
●●
●●
F
F FB

H ●
●
●C ●
●
+ H ●
H ●
+ + H ●
+ CH
HHH
H HH
H
C
QUÍMICA 2º BACHILLERATO Enlace Químico - 10 -
B: 1s2 2s22p1
F: 1s2 2s22p5
2.- Alrededor del átomo central (B) se disponen tres pares de electrones
3.- La disposición geométrica que minimiza sus repulsiones es la de triangular plana (Geometría Electrónica)
4.- No existen pares no enlazantes que modifiquen la Geometría Electrónica.
5.- En consecuencia la Geometría molecular para el BF3 es la de triangular plana donde el ángulo F – B – F es de 120º.
● Ejemplo 3. Molécula de metano (CH4)
1.- Configuraciones y estructura Lewis: C: 1s2 2s22p2
H: 1s1
2.- Cuatro pares de electrones enlazantes alrededor del átomo de carbono
3.- La Geometría electrónica que minimiza las repulsiones entre ellos es la tetraédrica y
5.- Como no hay pares no enlazantes la Geometría molecular será tetraédrica con los cuatro enlaces dirigidos hacia los vértices de un tetraedro regular en cuyo centro se encuentra el átomo de carbono. El ángulo de enlace H – C – H es de 109,5 º
Pero ¿qué ocurre cuando el átomo central de una molécula o un ion poliatómico presenta algún par de electrones sin compartir (no enlazante)?
● Ejemplo 4. Molécula de amoníaco (NH3)
1.- Configuración electrónica y estructura Lewis N: 1s2 2s22p3
H: 1s1
2.- El átomo de nitrógeno, átomo central, tiene cuatro pares de electrones en su capa de valencia; tres de ellos son enlazantes y el cuarto no enlazante (no compartido).
3.- La Distribución Electrónica tetraédrica es la que minimiza las repulsiones de los cuatro pares.
4.- La presencia de un par electrónico no enlazante en uno de los vértices del tetraedro hace que los otros tres vértices del mismo queden ocupados por los átomos de hidrógeno.
5.- La Geometría Molecular resultante es una pirámide trigonal cuya base se encuentra formada por los átomos de hidrógeno. Los ángulos de enlace observados H – N – H, de 107º, son ligeramente inferiores a los del tetraedro (109,5º). La razón estriba en que los pares de electrones no compartidos tienen un requerimiento espacial mayor; éstos son atraídos únicamente por el átomo central, mientras que los pares compartidos se encuentran sometidos a la atracción de dos núcleos diferentes.
● Ejemplo 5. Molécula de agua (H2O). Una vez conocidas las configuraciones electrónicas del átomo de oxígeno y del hidrógeno, obtenemos la estructura Lewis para esta molécula.
Comprobamos que el átomo de oxígeno (átomo central) se encuentra rodeado de cuatro pares de electrones, por lo que la Geometría Electrónica será tetraédrica. Como de los cuatro pares electrónicos sólo dos son enlazantes, la Geometría Molecular será lineal con un ángulo de enlace H – O – H de 104,5 º
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
O HH●●
●●
H
HO 104,5
NH
HH●●
H HH
N

QUÍMICA 2º BACHILLERATO Enlace Químico - 11 -
menor que el observado en la molécula de amoniaco debido al requerimiento espacial de los dos pares de electrones son compartir.
Moléculas con enlaces múltiples
También se puede aplicar la TRPECV a las moléculas que presentan enlaces múltiples.
En la molécula de eteno observamos que cada átomo de carbono cumple la regla del octeto formando dos enlaces sencillos con dos átomos de hidrógeno y uno doble con el otro carbono. La TRPECV considera el enlace doble, y en general los enlaces múltiples, como si fuera sencillo, ya que los dos pares de electrones compartidos se sitúan en la zona internuclear como lo haría un solo par electrónico.
La geometría de cada átomo de carbono es triangular plana. Sin embargo el mayor requerimiento espacial de los dos pares de electrones del enlace doble, que se encuentran localizados en la misma posición, hace que los ángulos de enlace sean ligeramente diferentes a los 120 º esperados para este tipo de geometría. El ángulo H – C = C es, aproximadamente, de 122 º, mientras que el de H – C – H es de 117 º
De forma similar la TRPECV propone para la molécula de CO2 una geometría lineal. El átomo central, que es el carbono, tiene cuatro pares de electrones a su alrededor (dos dobles enlaces), pero a efectos geométricos cada doble enlace ocupa una única posición; la manera de minimizar sus repulsiones es que la molécula sea lineal.
EN13.- Teniendo en cuenta la TRPECV, indica la geometría de las moléculas BH3, PF3, CH3I, H2Se, BeF2, HCN y PCl5
EN14.- Explica, a partir de la TRPECV, la geometría de los iones H3O+ y NH4+
Departamento de Física y Química I.E.S. GALLICUM – Zuera -
C = CH H
H H
= C =O●●
●●O●●
●●