Elección de imágenes médicas. · aérea en las vistas que conforman el estudio (generalmente...
Transcript of Elección de imágenes médicas. · aérea en las vistas que conforman el estudio (generalmente...

Biomodelo de vía aérea y pulmones.
Elección de imágenes médicas.
Se recomienda el uso de un set de imágenes médicas provenientes de un estudio
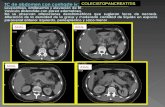
CT de tórax. No se requiere la utilización de contrastes ni marcaciones especiales. Esto
se debe a que el software aprovecha la diferencia en la escala Hounsfield entre tejidos y
espacios aéreos para la segmentación.
Por otro lado, el estudio mencionado permite una visualización directa de la vía
aérea en las vistas que conforman el estudio (generalmente coronal, axial y sagital).
Puede, además, segmentarse la vía aérea y pulmonar completa, ya que el estudio CT de
tórax incluye el conjunto de ambos pulmones.
Anonimización de imágenes médicas.
Se recomienda que las imágenes se encuentren en formato DICOM y
anonimizadas para evitar la visualización y probable divulgación de datos personales
sensibles. La mayoría de los sistemas PACS permiten la anonimización de los estudios
en formato DICOM al momento mismo de ser exportado. Resulta sumamente útil
realizar la anonimización de datos in-situ para evitar tener que acudir a herramientas
complementarias para llevar adelante la tarea.
Es importante recordar que el formato DICOM contiene, además del archivo de
imágenes propiamente dicho, un conjunto de protocolos que refieren a información,
protocolos de comunicación, esquema de organización en niveles (DICOMDIR), etc.
Para la tarea de anonimización, se opera sobre el DICOM header, que engloba al
conjunto de información asociada a un set de imágenes bajo una misma fila. Mantiene
una codificación estándar que, al ser leída, muestra un conjunto de etiquetas que
representan la información asociada a ese set de imágenes.
El proceso de anonimización también se denomina “limpieza” —cleaning— del
dataset. En general, se reconoce que “limpiar” las etiquetas asociadas a “Patient's
Name”, “Patient's ID” y “Accession Number” asegura una total anonimización del
dataset. En cualquier caso, se recomienda las siguientes opciones de anonimización:
1. Aplicaciones web: existe una variedad de herramientas gratuitas diseñadas
específicamente para cargar, modificar y exportar sets de archivos DICOM.
Estas herramientas modifican directamente la información ubicada en el
DICOM header y permiten, posteriormente, generar un nuevo conjunto de
archivos DICOM y un nuevo DICOMDIR para ser almacenado o traspasado a
algún medio digital —CD, por ejemplo—. Se recomienda
http://www.dclunie.com/pixelmed/software/webstart/DicomCleanerUsage.html
2. Mimics de Materialise: el software recomendado para la segmentación pulmonar
también incluye un módulo para anonimizar el set de imágenes cargado como un
nuevo proyecto. Seleccionando el acceso directo al módulo Anonymize, se
abrirá una pestaña que incluye tres tablas: Modify, Keep y All donde se dispone
la información correspondiente al DICOM header. En Modify, se observan con
su correspondiente etiqueta y valor asociando la información que será

modificada (para completar la anonimización) y, en Keep, las etiquetas que no
contienen información sensible que serán conservadas. Mimics, al hacer un click
sobre Anonymize, realizará el proceso de manera automática.
Preprocesamiento.
Para el caso de segmentación de vía aérea y utilizando los módulos de
segmentación avanzada que ofrece Mimics, no se recomienda ningún tipo de
preprocesamiento previo de las imágenes. Esto es así ya que el módulo utiliza el gran
contraste que existe entre las vías aéreas y el resto de los tejidos para generar los sólidos
—o partes— que darán lugar al biomodelo. Resulta más importante la posibilidad de
reconocer correctamente y, para ello, tener fuertes conocimientos anatómicos, las
fisuras de los lóbulos pulmonares, las ramificaciones de la tráquea, las medidas
anatómicas normales de cada estructura, etc.
Segmentación utilizando Mimics 21.0
Creación de un nuevo proyecto.
La creación del proyecto requiere de la simple selección del set de imágenes a
utilizar. Se recomienda, como se mencionó anteriormente, utilizar archivos DICOM.
En caso de contar con varias sesiones de un mismo estudio para un paciente, las
mismas se pueden “mergear”, proceso que permite una mejor visualización de los
cortes. En caso de generarse superposiciones (esto ocurre porque al mergear diferentes
sesiones el nuevo set de datos generado puede contener más de una imagen para una
idéntica posición espacial, estas posiciones espaciales se identifican por un número) se
puede permitir al software solucionar la superposición priorizando la visualización de
una imagen por sobre otra. También, una vez generado el proyecto, en la solapa Image,
se puede modificar la imagen seleccionada para cada punto espacial cuando exista más
de una opción.
Antes de comenzar.
En este punto, se propone un flujo de trabajo semi automático para alcanzar un
modelado con suficiente fidelidad para usos educativos. Es importante notar que el
tiempo dedicado a trabajar con el módulo de segmentación convencional, entre cada
paso de la segmentación semi automática (que utiliza el módulo de segmentación
avanzada), puede mejorar notoriamente la calidad —medida en fidelidad con el tejido
en las imágenes médicas— del biomodelo final.
Módulo segmentación avanzada: pulmonar.
El primer paso para generar el biomodelo es segmentar el comienzo de la vía
aérea: la tráquea torácica. En general, por el límite superior que se suele establecer en

las TC de tórax, en la gran mayoría de los casos, la tráquea no puede segmentarse desde
su origen, sino que se obtiene un modelo de los últimos ⅔ tramos de esta.
Utilizaremos la opción de segmentar vía aérea. Una vez seleccionada la solapa,
se abrirá una ventana que incluye las siguientes opciones de configuración —settings—:
1. Preprocessing: permite la incorporación de un filtro previo a la segmentación
automática. El filtro elimina el ruido. Es importante notar que la recomendación
general es no utilizarlo, excepto en casos donde el algoritmo falla en generar las
ramificaciones principales de los bronquios.
2. Leakage detection: decisión de compromiso entre el derrame (falsos positivos) y
una segmentación insuficiente. En general, esta opción funciona bajo prueba y
error, debiendo el usuario optar por la opción que asegure la mayor cantidad de
ramas sin exagerar la cantidad de falsos negativos.
3. Part postprocessing: se recomienda tildar la opción. Simplemente, reduce la
cantidad de triángulos que conforman el sólido tridimensional que se genera a
partir de la segmentación.
Una vez seleccionados los parámetros, se debe presionar la tecla Start e indicar
subsecuentemente dos puntos: el primero corresponde al inicio de la tráquea y el
segundo marcará la dirección hacia donde evoluciona la tráquea. El primer punto de
referencia resulta de mayor importancia ya que significará el “límite” superior de la
segmentación. Se recomienda elegir el punto más caudal en el que se observe el tramo
de tráquea en su set de imágenes. Utilizar para tal fin la reconstrucción sagital.
Figura 49. En blanco se marcan dos puntos a modo de ejemplo para la segmentación de vía
aérea. Fuente elaboración propia.

Luego de este primer paso, existen múltiples opciones para trabajar antes de
generar el sólido sobre la segmentación. Las acciones por realizar son manuales y se
realizan sobre la segmentación propiamente dicha o sobre las distintas perspectivas del
set de imágenes.
1. Correcciones de segmentación insuficiente: del mismo modo en que se indicó,
en primera instancia, por medio de dos puntos, la dirección de la tráquea, se
pueden agregar ramificaciones terminales que no hayan sido identificadas
automáticamente por el algoritmo. Para ello, resulta útil “navegar” los cortes
para realizar correcciones sobre la perspectiva coronal, ya que permite una vista
frontal de la ramificación de la tráquea. Al seleccionar dos nuevos puntos de
inicio y fin y seleccionar la opción Continue, el algoritmo identifica elementos
faltantes en esa dirección, agregando la rama faltante.
Figura 50. Se indica cómo, manualmente, completar una rama faltante. La segmentación
inicial se muestra en color violeta. Fuente elaboración propia.
2. Correcciones de derrame —leakage—: según el nivel de leakage seleccionado,
nuestra segmentación inicial tendrá mayor o menor tendencia a incluir falsos
positivos. Es importante identificar estos puntos antes de continuar, ya que
representan ramificaciones que no son verdaderas. En bronquios patológicos es
común observar zonas de gran derrame que vuelven casi imposible la
segmentación automática, ya que llevan al algoritmo a identificar un número alto
de ramas que no son parte de la tráquea y que corresponden a espacios aéreos
muertos. La metodología consiste en seleccionar con clic izquierdo el elemento o

rama defectuoso y mediante clic derecho elegir alguna de las siguientes opciones
para solucionar el problema:
a. Marcador de leakage: existe la opción de permitir que el software accione
sobre una porción que se reconoce como derrame, al colocar un marcador
Mimics recorrerá el contorno de la rama e identificará las diferencias de
contraste entre los diferentes bordes, eliminando el derrame en la zona. El
marcador se identificá como un objeto, lo que permite su posterior
eliminación. A continuación, se muestra un ejemplo donde se observa
claramente una zona de leakage. En general, la zona observa un
“amontonamiento” que no representa continuidad con el tramo anterior.
Figura 51. Leakage que debe ser corregido antes de continuar. Fuente elaboración
propia.
b. Elimina -delete-r: otras de las opciones, en caso de identificar una rama
que no corresponde o una ramificación defectuosa es la eliminación de la
porción. También, puede seleccionarse la opción delete with children que
eliminará todas las ramificaciones posteriores que nazcan o sean
continuación de la rama a eliminar.
c. Re-segmentar: permite generar un crecimiento de región —similar a la
opción region growth del módulo de segmentación—, pero sobre la
porción elegida. Puede corregir errores asociados al ruido del set de
imágenes, para ello, cuando se observa una zona de derrame
probablemente asociada a ruido, se debe seleccionar el filtro de ruido —
noise filter— y aumentar la detección de derrame. Puede ocurrir que
ramificaciones antagónicas de una rama avancen en desigualdad de
condiciones, en general, cuando se observa esta situación es recomendable
realizar re-segmentación de la rama madre.

Figura 52. Resegmentación. Fuente elaboración propia.
Figura 53. Re-segmentación, re-identificando la continuación de una rama que aparece truncada. Fuente
elaboración propia.

Figura 54. Se observa la corrección en la rama al re-segmentar. Fuente elaboración propia.
d. Subdividir: opción a elegir cuando se aprecia una porción de vía aérea que
representa correctamente a una ramificación, pero que incluye una zona
de derrame, esto permite separar y eliminar solamente la zona errónea.
3. Generación de sólido: una vez finalizada la etapa de segmentación, se debe
seleccionar la opción “Calculate Part…” que genera el sólido correspondiente.
A continuación, se puede agregar a la segmentación los pulmones con sus
respectivos lóbulos. Para ello, el software debe tener un eje desde dónde realizar
aproximaciones geométricas y generar de manera semiautomática los tejidos
correspondientes. El conjunto de medidas básicas (diámetro, distancias, tortuosidad, etc.)
se deben, para este caso, vincular a una línea-central que recorra la estructura y sirva como
eje. Para ello, existen dos opciones:
1. Generar una centerline mediante la solapa Fit Centerline, que crea una línea-
central que sirve a modo de columna vertebral y luego etiquetarla (procedimiento
que se describe a continuación).
2. Generar una centerline con autoetiquetado mediante la opción New Centerline
Label en el módulo pulmonar, opción recomendada y que se describe en el
siguiente inciso.
Bajo el módulo de análisis —Analyze— se encuentra la solapa Fit Centerline. Se
debe seleccionar el sólido generado mediante la segmentación de vía aérea y setear los
parámetros correspondientes:
1. Smooth factor: determina los límites espaciales de la Centerline. La misma
continuará hasta superar una desviación determinada por una medida —en mm—
representada por el radio promedio de la estructura, multiplicado por el factor de
smooth; se detiene si el valor en alguna rama es mayor a un límite (mm) = factor
de smoothing * radio promedio de la estructura. En general, para donde existan
múltiples tortuosidades (por ejemplo, una vía aérea patológica con espacios
muertos que muestran curvas pronunciadas sobre la que viaje el aire en cada ciclo

inspiración-espiración) es necesario disminuir el factor de smooth para evitar que
la Centerline continúe por fuera de la estructura.
2. Show params: permite modificar dos parámetros que conforman el factor de
smooth. En caso de que se requiera una distancia fija entre puntos o se quiera
determinar la resolución espacial de forma manual, se puede hacerlo mediante
esta solapa. Se recomienda, simplemente, modificar el factor de smooth hasta
llegar a una Centerline que alcance toda la extensión de nuestra sólido sin mover
los parámetros base.
Al seleccionar la opción fit centerline el algoritmo procederá a determinar los
caminos y puntos de corte correspondientes, como se muestra en la figura 55.
Posteriormente, esta Centerline debe etiquetarse, siguiendo la nomenclatura IKEDA
Figura 55. Ejemplo de generación de Centerline. Fuente elaboración propia.
Como se mencionó anteriormente, el software requiere etiquetar las distintas
ramificaciones de los bronquios siguiendo el protocolo IKEDA para proceder a la
segmentación lobar y pulmonar. Este punto resulta un tanto controversial. Las
ramificaciones bronquiales fueron estudiadas en profundidad a mitad del siglo XX,
arribando a estudios que proponen ramificaciones normales, como el mencionado, la
nomenclatura IKEDA (Netter, 1979). Sin embargo, estudios posteriores, como el

realizado en 2014 —Wim Vos, Sergiy Volkovych, Cedric Van Holsbeke, Bart
Veeckmans, Jan De Backer, Wilfried De Backer, 2014, Nomenclature of
bronchopulmonary anatomy: 60 years later. European Respiratory Journal— muestran
que el etiquetado propuesto por IKEDA, en 1979, presenta una prevalencia bastante baja,
como se muestra en la figura y tabla siguiente, propiedad del paper citado:
Figura 56. Prevalencia de la nomenclatura IKEDA.
El estudio fue realizado mediante espirometrías capturadas por CTs y en un total
de 100 sujetos. Sin embargo, esto comprueba que las ramificaciones principales y
caudales tienen una alta prevalencia en la mayoría de los pacientes sanos y deben
corregirse en caso de encontrar discrepancias.
Volviendo al procedimiento, se debe seleccionar la solapa New Centerline Label
y seleccionar un sólido de vía aérea. Mimics genera una centerline con etiquetado. Se
debe arribar a lo siguiente:

Figura 57. Centerline y labels.
Se observan dos columnas:
1. Izquierda: compuesta por las etiquetas identificadas que deben
corroborarse y pueden editarse/modificarse/eliminarse según corresponda.
2. Derecha: etiquetas sin identificar. Pueden agregarse manualmente o
ignorarse. En general, es importante contar con las etiquetas de
ramificaciones que muestran mayor prevalencia.
En nuestro caso de ejemplo, se observa que una rama de alta prevalencia se
encuentra ausente (B8L):

Figura 58. En rojo se observa una rama mal etiquetada.
Seleccionando la rama problemática y haciendo clic derecho, Mimics nos permite
corregir la etiqueta. Quedando como sigue:
Figura 59. En rojo se observa la etiqueta corregida.
En la solapa Edit Label, se pueden continuar realizando modificaciones.

El siguiente paso consiste en generar el modelo que, finalmente, servirá de input
para la generación del volumen pulmonar. Esta herramienta genera cortes a alturas
determinadas con planos axiales al recorrido de la tráquea.
Figura 60. Se observa los planos de corte generados
Fuente elaboración propia.
Los planos pueden corregirse manualmente, para ello se deben seleccionar y
desplazar. Es importante asegurarse de que los planos correspondan a un corte axial
respecto a la ramificación en cuestión.
Los planos que figuran en rojo deben ser corregidos para poder ser utilizados. Una
opción, alternativa y no recomendada, es eliminarlos, lo que evitará que el algoritmo
utilice la rama correspondiente al corte borrado como referencia de corte.
El último paso consiste en generar los pulmones con sus respectivas fisuras que
determinan los lóbulos. Para ello, el software recomienda como input para la solapa una
vía aérea que haya sido cortada a b-level —paso que realizamos anteriormente—.
La segmentación es generada automáticamente y los planos de corte pueden ser
arrastrados y modificados, en caso de que se observen errores en las posiciones de los
lóbulos. En nuestro caso, se observa un error en la fisura oblicua izquierda que genera

que una porción del lóbulo izquierdo inferior se confunda con el lóbulo izquierdo
superior.
Figura 61. Corrección fisura.
Fuente elaboración propia.
Figura 62. Se observa el error más claramente en el modelo azul de pulmón izquierdo.
Fuente
elaboración propia.
Se deben corregir estos errores o habrá problemas al momento de generar los
modelos sólidos. Esto se hace indicando nuevos puntos —o removiendo puntos
innecesarios— que permitan a la recta que genera el plano de corte no dirigirse sobre un
volumen erróneo. La opción “Assign to” permite modificar un punto, erróneamente
asignado a una fisura, a la fisura correcta.

Figura 63. Corrección fisura oblicua izquierda.
Fuente elaboración propia.
Para el caso de estudio con el error indicado, se agregaron dos puntos en la
perspectiva sagital, pero permitieron corregir la recta que separa los lóbulos superior e
inferior del pulmón izquierdo.
Figura 64. Se observa claramente como la fisura deja de ubicar tejido correspondiente al lóbulo
inferior izquierdo como parte del lóbulo superior
izquierdo. Fuente elaboración propia
.

Figura 65. Ídem figura 64. Perspectiva Coronal.
Finalmente, se obtiene un modelo de la vía aérea y los pulmones. Para pasar a
postprocesamiento se cuenta con dos opciones: un modelo que incluye los pulmones
izquierdo y derecho, y otro que permite exportar los pulmones separados en lóbulos,
según la aplicación deseada se puede elegir con cual modelo continuar el
postprocesamiento. Mimics permite exportar el modelo mediante la solapa
Export en el menú FILE.
Postprocesamiento utilizando 3-Matic 13.0.
Figura 66.
Una de las mejores opciones para realizar postprocesamiento (o, como mínimo,
una parte de él) de los sólidos generados mediante 3D Slicer es a través de 3-matic de
Materialise.
Según sus desarrolladores se trata de un “CAD anatómico”, diseñado
específicamente para trabajar con biomodelos. Al ser parte del paquete de Materialise, se
encuentra optimizado para ser utilizado en conjunto con Mimics y presenta la opción de
corregir errores frecuentes en la segmentación del biomodelo y, también, realizar tareas
estándar de un CAD: análisis, mediciones, fixeo de problemas y trabajo sobre las
superficies (smoothing, remeshing, etc.).
Para 3-matic los sólidos importados son “partes” y sobre ellos se pueden realizar
“operaciones” que modifican sus propiedades. En el panel de objetos —Object tree—,
encontraremos cada parte con su respectiva metadata y con los distintos objetos que
componen su superficie —por ejemplo, un sólido puede estar compuesto por varias
curvas y bordes—. Las operaciones se ubican en el panel con el mismo nombre, permite
modificar parámetros y, obviamente, requieren de la selección de una parte —el sólido
sobre el que se realizará la operación—. Esta terminología, seguramente, resultará
familiar para cualquier usuario de software CAD.
Por último, se muestran las opciones de visualización. En general, se recomienda
seleccionar la opción que permite visualizar los triángulos con sus nodos asociados,
cuando se trabaje sobre el mallado.

Figura 67. Visualización.
Se presenta un workflow de postprocesamiento que incluye los siguientes
aspectos:
1. Módulo Fix
2. Módulo Remesh
3. Módulo Measure y Analyze
Módulo Fix.
Una de las mejores opciones para resolver problemas específicos del mallado,
que se generan al exportar a 3-Matic, es el módulo Fix. En general, es recomendable
comenzar por utilizar el Fix Wizard que, como su nombre lo indica, es una herramienta
automática que permite detectar errores en las normales de los triángulos,
superposiciones, contornos defectuosos, intersecciones y demás que suelen ocurrir. Se
debe realizar para cada sólido/volumen que hayamos importado. Para ello, basta con
seleccionar parte por parte y seleccionar la opción “Update”. Se mostrarán en rojo los
errores detectados y, seleccionando la opción “Follow Advice”, 3-Matic procederá a
corregirlos.

Figura 68. Módulo Fix - Fix Wizard.
El siguiente paso de nuestro flujo de trabajo es importante para facilitar la tarea
sobre las mallas. Existen dos opciones más que se recomiendan utilizar/probar dentro
del módulo Fix, antes de pasar al siguiente punto.
Las operaciones Smooth y Wrap generan una versión simplificada de nuestro
tejido, disminuyendo el número de triángulos totales necesarios para representarlo. Esto
simplifica diferentes tareas posteriores, pero, además, evita malas representaciones de
ciertos puntos problemáticos.
Figura 69. La operación Smooth es multipartes.
Se recomienda probar con diferentes factores de suavizado —smooth— hasta
encontrar uno que no genere problemas.
Existen operaciones interesantes que quedan a criterio del usuario. Por ejemplo,
para representaciones idealizadas, se puede aplicar la operación “Reduce”, que reduce
notablemente el número de triángulos utilizados para representar el tejido. Quizás no
resulte una opción tan conveniente para el caso de una aplicación clínica.

Remesh.
Los sólidos suelen utilizar triángulos para representar estructuras. El objetivo del
uso de este módulo es mejorar y optimizar esa representación, modificando las mallas
que conforman a cada tejido.
El conjunto de operaciones que permite realizar 3-Matic sobre el mallado es
bastante amplio. Consisten en un grupo de herramientas, en su gran mayoría
automáticas, que buscan mejorar o modificar la calidad del mallado.
En este punto, no existe una recomendación general. La opción seleccionada
dependerá de los objetivos del usuario. Una opción que presenta buenos resultados es
seguir el siguiente esquema:
1. Probar una operación de Remesh.
2. Aplicar Smooth al sólido resultante.
3. Deshacer 1 y 2 y probar nuevamente con otra operación de Remesh.
En general, lo anterior permitirá mediante observaciones seleccionar la mejor
aproximación para los objetivos del usuario.
En nuestro caso, en particular, el objetivo es llegar a un tejido representativo, pero
idealizado, por ello se aplicaron operaciones que reducen el número de triángulos en el
remesheado, pero manteniendo la estructura.
Figura 70. Uniform remesh. Se observan los cambios. Posteriormente se aplicó Smooth.
Se determina que el Remesh elegido, para nuestro estudio, resulta excesivo. Por
ello, se opta por aplicar un remesh alternativo.

Figura 71. Quality Preserving Reduce Triangles. Se observa una representación similar con un número
mucho mejor de triángulos. Posteriormente a la operación Remesh, se aplicó Smooth.
Analyze & Measure.
El uso en conjunto de estos dos módulos permite realizar mediciones sobre
nuestro biomodelo. Las mediciones pueden expresarse mediante cotas. El flujo de
trabajo propuesto es el siguiente:
1. Analyze: generar líneas, arcos y demás representaciones geométricas sobre las
porciones de tejido a acotar.
2. Measure: acotar las representaciones generadas anteriormente.
Acotar nuestro biomodelo presenta múltiples beneficios y puede ser de mucha
utilidad al momento de determinar si nuestro paciente/sujeto de estudio presenta
estructuras anatómicas normales, para planificar una intervención o simplemente para
sumar información diagnóstica.
Ejemplo de aplicación.
● Analyze
○ Create Line: genera una recta —línea—. En este caso, será utilizada para
acotar el largo (altura) de nuestra tráquea de prueba.
○ Create Arc: genera un arco. Será utilizada para acotar el radio de la
tráquea de prueba.
Para lo anterior, la recomendación general es guiarse por las distintas perspectivas del
modelo (accesibles mediante el NumPad) y por los valores asociados a los ejes de
referencia. Cada punto del espacio en nuestra Work Area está representado por tres
valores que especifican su posición según los ejes X, Y, Z. Esto nos permite generar una
línea que sigue una trayectoria recta sin desviaciones, lo que es importante al momento
de determinar la altura de nuestra tráquea, por ejemplo.

Figura 72. Se observa cómo solamente varía el valor representativo de la posición de nuestra
Línea Tráquea sobre el eje Z.
Para generar el arco, se aproxima mediante selección de tres puntos (para ello,
elegir esta configuración sobre las propiedades de la operación) y se recomienda utilizar
la vista superior —NumPad 8—.
Figura 73. Arco para poder acotar el radio de nuestra Tráquea. Vista Superior.
● Measure
○ Distance
○ Radius
Para acotar las herramientas geométricas que hemos generado, bastará con
seleccionarlas como entidad, a la hora de utilizar las operaciones mencionadas en el
Módulo Measure.

Figura 74. Altura y radio de nuestra Tráquea con sus cotas correspondientes. Vista Frontal.
Conclusiones
El flujo de trabajo propuesto no es el único y los pasos a seguir dependen, en
gran medida, de los sets de imágenes con los que se cuente. En general, siguiendo las
indicaciones anteriores, y partiendo de un estudio de CT sin necesidad de contraste y en
una persona con vía aérea y pulmones normales, se obtendrá un biomodelo aceptable
para ser usado como herramienta didáctica o con fines educativos en general.