El Bloque "S"
Transcript of El Bloque "S"

Prof. María E. Doñé

BLOQUE SGRUPO #1

Presentacion
Carlos Manuel #4Michael Marte #13Luz meris Garcías #20 Massiel Rodríguez #25Katiuska Úbeda #29Ramón Manuel Castillo #28

Bloque s Los Elementos del bloque s ( del ingles sharp
que significa principal). Son aquellos que esta situado en los grupos 1 y 2 de la Tabla periódica. En estos elemento el nivel energético mas externo corresponde a orbitales s. en los orbitales caben 2 electrones, y estos elemento tiene tendencia a perder estos electrones, alcanzando así la configuración electrónica de gas nobles mas cercanos.

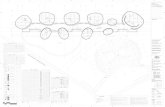
En el diagrama se muestra la tabla periódica dividida en bloques. Los elementos del grupo 1 (excepto el hidrógeno) se llaman alcalinos, y los del grupo 2alcalinotérreos. El helio es un gas noble y el hidrógeno no se clasifica en ningún grupo en concreto.

Grupos Del Bloque S
Grupo IA:Grupo 1:Metales Símbolo ConfiguraciónAlcalinolitio Li [He]2s1sodio Na [NE]3s1potasio K Ar]4s1rubidio Rb Kr]5s1cesio Cs Xe]6s1francio Fr [Rn]7s1
El francio es radiactivo: 212Fr (20 m, α).

En el bloque s de la tabla periódica encontramos dos columnas de elementos. Esto es así porque solo hay un orbital s por nivel y este tipo de orbital puede contener como máximos dos electrones. Estas 2 columnas pertenece a los grupos IA Y IIA.

ELEMENTOS DEL GRUPO IA

Grupo IA
En los elementos q vimos anteriormente se les conoce como metales alcalinos, haciendo alusión al hecho que estos elementos son constituyente comunes de las cenizas vegetales. El termino alcalino también hace referencia al carácter básico de sus óxidos.

Grupo IA

…

Elementos del grupo IIA

Grupo IIA
El Grupo IIA Se suele identificar comúnmente como los metales alcalino-térreos; son alcalinos porque sus óxidos (cal= CaO y Magnesia = MgO) Presentan carácter básico, y Térreos porque tiene características de las tierras de los alquimista, a saber, carácter metálico, insoluble en aguas e inalterables al fuego.

Los Metales Alcalinos
Los metales alcalinos aparecen en la naturaleza combinados con los halógenos y los elementos del grupo del oxigeno formando compuesto iónicos solubles en agua.


Obtención de los metales alcalinos
Para preparar los metales alcalinos es preciso reducir el cation + 1 y esto puede
hacerse química o electroliticamente.

Propiedades
Físicas: En estado puro los metales alcalinos ( Li, Na, K, Rb, Cs y Fr ) son muy brillantes y mas ligero q el resto de todos los metales.
Químicas: en los metales alcalinos, la existencia de un solo electrón en el orbital s, exterior es una estructura central de gas noble, hace la química de los elementos del grupo IA sea el mas simple, pues en todos los compuesto se representa valencia +1.


Se Dice que los compuesto de el jabón lo forman metales alcalinos

Compuestos
Los elementos alcalinos, al reaccionar con el hidrogeno y los no metales del bloque p, producen hidruros, óxidos, hidróxidos, sulfato, halogenuros y carbonatos.
Óxidos de los metales alcalinos. Cuando se calienta un metal alcalino en la atmósfera u oxigeno se obtiene oxido

Hidruros de los metales alcalinos. Se preparan fácilmente calentando el metal en atmósfera de hidrogeno.
Hidróxido de los metales alcalinos. El hidróxido de litio presenta una diferencia de comportamiento con relación a los de más hidróxidos de los metales alcalinos.


Metales Alcalino- Térreos
Los metales alcalino-térreos son los elementos :
Berilio Be Z=4Magnesio Mg Z=12Calcio Ca Z=20Estroncio Sr Z=38Bario Ba Z=56Radio Ra Z=88



Obtención
Las fuentes naturales para la obtención del os metales alcalinotérreos son agua de mar y de pozo salinos profundo.
Todos los alcalinotérreos se obtienen por electrolisis de sus halogenuros o hidróxidos fundidos y por reducción con agente reductores adecuados.

Propiedades
Físicas: Los metales alcalinotérreos presentan carácter metálico, intenso brillo y buena conductividad.
Químicas: los metales alcalinotérreos son poderos agente reductores. El berilio presenta propiedades químicas lógicamente diferente a las de los demás elementos de el grupo, forma compuesto predominante covalente.

Compuestos De los metales alcalino térreos
Hidruros Óxidos
HidróxidosSilicatos
halogenuros



Usos de los metales alcalinos
Litio unos de los usos mas importantes de este en la matalugica.
Sodio es útil para eliminar óxidos y sulfuros en la industria.
Potasio este tiene su aplicación muy importante en la agricultura, se usa como fertilizante.
Cesio el mas reactivo de los metales debido a su reducido potencial de ionizacion

Usos de los metales alcalino térreos
Bario y Estroncio. Tiene su uso en pirotecnia, como productores de efectos cromáticos.
Magnesio. Se Usa Como En la fabricación de fuentes luminosas como la fotografía